
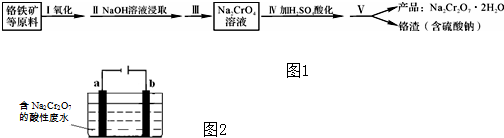
分析 工业铬铁矿(FeO•Cr2O3,含少量Al2O3和SiO2),首先是加入碳酸钠煅烧,FeO•Cr2O3和碳酸钠在一起作用下发生氧化还原反应,化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2(g)═8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),生成氧化铁,铬酸钠和二氧化碳,加入氢氧化钠,2NaOH+Al2O3=2NaAlO2+H2O,除去氧化铝,将溶液的pH调至7~8并煮沸,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,加入硫酸酸化反应为:2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,铬渣为Na2SO4.
(1)Cr元素为24号元素,原子核外有24个电子,根据核外电子排布规律书写,价电子排布式为外围电子排布式;
(2)化学反应中有化合价升降的反应是氧化还原反应,还原剂是在反应中所含元素化合价升高的反应物,还原剂中化合价升高的元素被氧化,依据化学方程式4FeO•Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,分析反应过程中元素化合价变化,计算电子转移总数得到;
(3)步骤II中加入NaOH溶液时氧化铝和氢氧化钠反应生成溶于水的偏氯酸钠和水,以便通过调PH以沉淀形式除去;
(4)a连接电源负极,所以a为阴极,连接石墨;b连接电源正极,所以b为电解槽的阳极;阳极铁发生氧化反应;
(5)根据铬元素守恒分析计算.
解答 解:(1)Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,它的外围电子排布式是3d54s1,
故答案为:3d54s1;
(2)步骤I中反应的化学方程式为:4FeO•Cr2O3(s)+8Na2CO3(s)+7O2(g)═8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),元素的化合价变化为:4个Fe由+2→+3,8个Cr由+3→+6,28个O由0→-2,转移28e-,化合价升高的元素被氧化,所以反应中被氧化的元素是Fe、Cr(或铁、铬),生成2mol Fe2O3时转移电子的物质的量为28mol,
故答案为:Fe、Cr(或铁、铬);28;
(3)步骤II中加入NaOH溶液时氧化铝和氢氧化钠反应:2NaOH+Al2O3=2NaAlO2+H2O,除去氧化铝,将溶液的pH调至7~8并煮沸,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,
故答案为:2NaOH+Al2O3=2NaAlO2+H2O;
(4)根据电解槽图示可知,a为阴极,a电极的电极材料是石墨,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:石墨;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(5)含Cr2O3为50%的铬铁矿30.4kg,含Cr2O3质量为30.4×106×50%g,流程中铬元素的利用率为80%,根据铬元素守恒,则最终能制得Na2Cr2O7•2H2O:$\frac{30.4×1{0}^{6}×50%g}{152g/mol}×2×298g/mol$×80%=23.84kg,
故答案为:23.84.
点评 本题考查了重铬酸钠制备的流程分析判断,物质性质和实验操作的分析应用,掌握电解原理、氧化还原反应原理、物质的分离提纯方法是解题关键,题目难度中等,侧重于考查学生的实验能力、分析问题、解决问题的能力.


科目:高中化学 来源: 题型:解答题
 ,由2个原子组成的分子是HF、阴离子是OH-.
,由2个原子组成的分子是HF、阴离子是OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ 1s22s22p6 | B. | Br 1s22s22p63s23p63d104s24p5 | ||
| C. | O2- 1s22s22p6 | D. | Cr ls22s22p63s23p63d44s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1+Q2>4Q3 | |
| B. | Q1+Q2<Q3 | |
| C. | 1mol氧气和2mol氢气的总能量高于1mol水的总能量 | |
| D. | 1mol氧气和2mol氢气的总能量低于1mol水的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
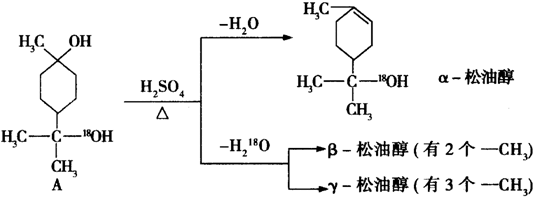
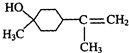 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$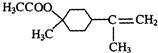 +H2O.
+H2O.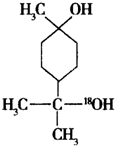 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$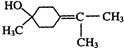 +H218O,该反应的反应类型是消去反应.
+H218O,该反应的反应类型是消去反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
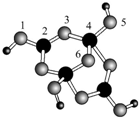 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字).
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是4 一5 min,因为在此段时间内反应放出的热量较多 | |
| B. | 在2一3min时间段内,用盐酸的浓度变化表示的反应速率为0.lmol/(L•min) | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入NaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com