
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
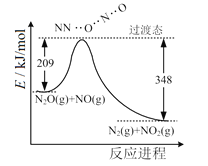
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
科目:高中化学 来源: 题型:
【题目】《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是()
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中氯离子浓度与50mL1mol·L-1的AlCl3溶液中氯离子浓度相等的是 ( )
A.150mL1mol·L-1的NaCl B.150mL3mol·L-1的KCl
C.75mL2 mol·L-1的CaCl2 D.75mL2mol·L-1的NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化合物的叙述不正确的
A. 纤维素是植物细胞壁的主要成分,它的单体(基本组成单位)是葡萄糖
B. 蛋白质是生命活动的主要承担者,它的单体是氨基酸
C. DNA是具细胞结构生物的遗传物质,它的单体是脱氧核苷酸
D. 磷脂是细胞膜的主要成分,只含有C、H、0三种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO45H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO45H2O受热分解的化学方程式为:CuSO45H2O(s) ![]() CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo D. N、P、K、Cu、Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支25 mL的酸式滴定管中加入0.1 mol/L的HCl溶液,其液面恰好在5 mL刻度处,若把滴定管中的溶液全部放入烧杯中,然后用0.1 mol/L的NaOH溶液进行中和,则所需NaOH溶液的体积( )
A. 等于5 mL B. 大于20 mL C. 等于20 mL D. 小于20 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①是通过O2与C反应实现的,测知生成14gCO时放出60kJ的热量,则其热化学方程式为 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克液态甲醇完全燃料放热25kJ,写出甲醇燃烧生成1molCO2的热化学方程式 。若将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极: 负极:
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H= - 400kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H= - 560kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+140kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―260kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+70kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将废旧锌锰电池处理得到含锰混合物,既能减少它对环境的污染,又能实现废电池的资源化利用。
Ⅰ. 回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。
(1)写出MnO(OH)与浓盐酸反应的化学方程式:_________。
Ⅱ. 锰回收新方法:向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnOOH + MnO2 + 2H2C2O4 + 3H2SO4 == 3MnSO4 + 4CO2↑ + 6H2O
(2)与使用浓盐酸回收锰相比,新方法的优点是_________(答1点即可)。
(3)欲以MnSO4溶液为原料制备MnCO3,选用的加料方式___________(填字母),原因是___________。
已知:Ksp(MnCO3)=2.3×10﹣11、Ksp[Mn(OH)2]=2.1×10﹣13
a. 将MnSO4溶液与Na2CO3溶液同时加入到反应容器中
b. 将MnSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c. 将Na2CO3溶液缓慢加入到盛有MnSO4溶液的反应容器中
d. 以上三种方式都无法得到MnCO3.
Ⅲ. 现以含锰混合物为原料制备锰锌铁氧体的主要流程如图l所示:
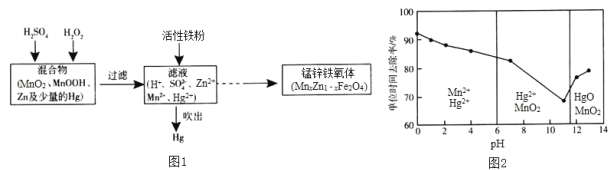
请回答下列问题:
(4)MnxZn1﹣xFe2O4中铁元素化合价为+3,则锰元素的化合价为___________。
(5)活性铁粉除汞时,铁粉的作用是_________(填“氧化剂”或“还原剂”)。
(6)酸浸时,MnO2与H2SO4、H2O2反应的离子方程式为__________________。
(7)除汞是以氮气为载气吹入滤液中,带出汞蒸气经KMnO4溶液进行吸收而实现的。在恒温下不同pH时,KMnO4溶液对Hg的单位时间去除率及主要产物如图2所示:
①写出pH=10时KMnO4溶液吸收汞蒸气的离子方程式________________。
②在强酸性环境中汞的单位时间去除率高,其原因除氢离子浓度增大使KMnO4溶液的氧化性增强外,还可能是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com