
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
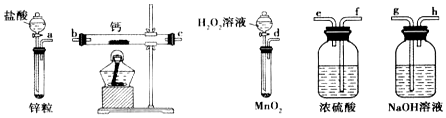

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
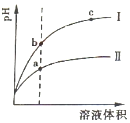 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸亚铁 | B. | 硫酸亚铁 | C. | 氧化铁 | D. | 氯化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com