
在常压和500℃时把O2和SO2按1∶2体积比混合,如果混合前O2为10 mol,平衡混合气体中SO3占总体积的91%。求:
(1)平衡时有多少摩尔O2?
(2)混合气体中SO2占总体积的体积分数是多少?
(3)SO2的转化率是多少?
科目:高中化学 来源: 题型:
完成下列化学方程式的配平
⑴ H2S + HNO3 ── H2SO4 + NO2 + H2O
⑵ C + H2SO4 ── SO2↑ + CO2↑ + H2O
⑶ Zn + HNO3 ── Zn(NO3)2 + NH4NO3 + H2O
⑷ NaClO3 + FeSO4 + H2SO4 ── NaCl + Fe2(SO4)3 + H2O
⑸ Fe(OH)2+ O2+ H2O── Fe(OH)3
⑹ KClO3+ HCl(浓)- KCl+ ClO2+ Cl2+ H2O
⑺ KMnO4 + HCl── KCl + MnCl2 + Cl2↑ + H2O
⑻ Fe(NO3)3+ NaOH+ Cl2── Na2FeO4+ NaNO3+ NaCl+ H2O
⑼ P + KOH + H2O── KH2PO4 + PH3↑
⑽ KCl+ KClO3+ H2SO4── K2SO4+ Cl2↑+ H2O
⑾ FeS2+ O2 - Fe2O3+ SO2
⑿ H2C2O4+ KMnO4+ H2SO4── CO2+ K2SO4+ MnSO4+ H2O
⒀ MnO2+ H++ Cl-── Mn2++ Cl2↑+ H2O
⒁ Cu+ H++ NO3-── Cu2++ NO↑+ H2O
⒂ NO3—+ Zn+ OH—+ H2O── NH3+ Zn(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
配平下列氧化还原反应方程式,并标明反应④电子转移的方向和数目。
① H2S+
H2S+ H2SO3——
H2SO3—— S↓+
S↓+ H2O
H2O
氧化产物是_________,还原产物是__________,二者质量比是________。
② Cl2+
Cl2+ KOH——
KOH—— KCl+
KCl+ KClO3+
KClO3+ H2O
H2O
氧化剂是________,还原剂是________,二者物质的量之比是__________。
③ KClO3+
KClO3+ HCl——
HCl—— KCl+
KCl+ Cl2↑+
Cl2↑+ H2O
H2O
HCl的作用是________,被还原的元素是__________,当反应过程中有3 mol电子转移时,可产生氯气________mol。
④ KIx+
KIx+ Cl2+
Cl2+ H2O——
H2O—— KCl+
KCl+ HIO3+
HIO3+ HCl
HCl
若KIx与Cl2的化学计量数之比为1∶8,则x=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校同学为探究Br2、I2和Fe3+的氧化性强弱,进行了如下实验。
实验①:取少量KI溶液于试管中,先加入溴水、振荡,再加入CCl4,振荡后静置,观察到下层液体呈紫红色;
实验②:取少量FeSO4溶液于试管中,先加入溴水,振荡,再继续滴加两滴KSCN溶液,振荡,观察到溶液呈红色。
(1)按要求写出下列反应的离子方程式
实验① 。
实验② 。
(2)由上述两个实验,对物质的氧化性可以得出的正确结论是________。
A.Br2>I2 B.Fe3+>Br2 C.Br2>Fe3+ D.I->Br-
(3)已知Fe3+的氧化性强于I2,请你从所给试剂中选择所需试剂,设计一个实验加以证明。(提示:请写出实验步骤、现象及结论)
①FeCl3溶液 ②碘水 ③KI溶液 ④稀H2SO4 ⑤淀粉溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)NaHCO3和NaHSO4的溶液混合后,实际参加反应的离子是________。
(2)实验室中不能用硫化钠溶液和氯化铝溶液混合来制取硫化铝,原因是______
(用化学方程式表示)。
(3)溶液中SO32-与H+不能大量共存,是因为发生了_________反应,酸性条件下NO3-与Fe2+不能大量共存,是因为发生了_________反应(填反应类型)。
(4)只选用一种试剂就能把浓度均为1 mol·L-1的Na2SO4、Na2SO3、Na2CO3、BaCl2溶液加以区别,这种试剂是。
A.CaCl2 B.AgNO3 C.H2SO4 D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:
2H2(g)+CO(g)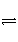
 CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol·L-1,求:
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol·L-1,求:
(1)达平衡时CO的转化率;
(2)该温度下的K。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中,不能用勒·夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O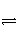
 HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对2H2O2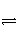
 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C.反应CO+NO2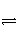
 CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D.合成氨反应:N2+3H2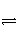
 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨反应:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图:
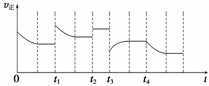
下列说法正确的是( )
A.t1时升高了温度 B.t2时使用了催化剂
C.t3时增大了压强 D.t4时降低了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是 ( )

A.实验I:振荡后静置,上层溶液颜色保持不变
B.实验II:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验IV:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com