
 W、X、Y、Z 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知 Y、Z 两种元素的单质是空气的主要成分,W 原子的最外层电子数与 Ne 原子的最外层电子数相差 1.
W、X、Y、Z 是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知 Y、Z 两种元素的单质是空气的主要成分,W 原子的最外层电子数与 Ne 原子的最外层电子数相差 1.分析 W、X、Y、Z是四种常见的短周期元素,Y、Z两种元素的单质是空气的主要成分,结合图中原子序数及原子半径可知,Z的原子序数大于Y,可知Z为O、Y为N;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N元素,而原子半径小于N原子,故X为H元素,以此来解答.
解答 解:由上述分析可知,W为Cl,X为H,Y为N,Z为O,
(1)W为Cl,Y为N,故答案为:Cl;N;
(2)最外层电子数=最高正价,最低价=最外层电子数-8,N元素的负价最低,为-3价,Cl元素的最高正价最大,为+7价,故答案为:-3;+7;
(3)化合物甲具有消毒杀菌作用,其化学式为HClO,化合物乙是一种常见的化肥,其化学式为NH4Cl,故答案为:HClO;NH4Cl;
(4)HYO3 的酸性比 HWO 强,不能说明 Y 的非金属性强于 W,因HClO不是氯的最高价氧化物对应水化物,应利用最高价氧化物的水化物酸性比较非金属性强弱,
故答案为:否,HClO不是氯的最高价氧化物对应水化物,不能证明非金属性强弱.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、原子半径及空气的成分来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

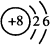 .
. ;物质n的用途有生产盐酸(任写一种即可).
;物质n的用途有生产盐酸(任写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ,G与F分别形成的简单离子半径大小关系为N3->Na+.
,G与F分别形成的简单离子半径大小关系为N3->Na+. 、
、 .
. ;
; ,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..
,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=-3 540 kJ•mol-1 | |
| B. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=-3 540 kJ•mol-1 | |
| C. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(g)△H=+3 540 kJ•mol-1 | |
| D. | C5H12(l)+8O2(g)═5CO2(g)+6H2O(l)△H=+3 540 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

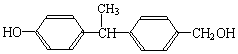 b.
b.
 d.
d.
 结构相似的醇不能被氧化为醛或酸.
结构相似的醇不能被氧化为醛或酸.
 .
.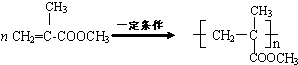 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com