
 Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.
Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.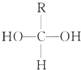 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
 或
或
分析 A发生水解反应C、D,结合题中信息可知,C的结构简式为CH3CHO,D酸化得到E,C氧化得到E,则D为CH3COONa,E为CH3COOH,B的相对分子质量为178,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B中碳氢原子个数之比为1:1,所以x=y,结合其相对分子质量知:x=y=$\frac{178-48}{13}$=10,所以B的分子式为C10H10O3,B水解生成E(乙酸)和F,F的分子式为C10H10O3+H2O-C2H4O2=C8H8O2,不饱和度为5,F具有如下特点:①能跟FeCl3溶液发生显色反应,②1molF最多可消耗2mol NaOH;③苯环上的一氯代物只有两种,则F含有2个酚羟基、含有1个-CH=CH2,且3个取代基处于间位或临位,则F的结构简式为: 或
或 ,据此解答
,据此解答
解答 解:(1)B的相对分子质量为178,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B中碳氢原子个数之比为1:1,所以x=y,结合其相对分子质量知:x=y=$\frac{178-48}{13}$=10,所以B的分子式为C10H10O3,B水解生成E(乙酸)和F,F的分子式为C10H10O3+H2O-C2H4O2=C8H8O2,不饱和度为5,F具有如下特点:①能跟FeCl3溶液发生显色反应,②1molF最多可消耗2mol NaOH;③苯环上的一氯代物只有两种,则F含有2个酚羟基、含有1个-CH=CH2,且3个取代基处于间位或临位,则F的结构简式为: 或
或 ,故答案为:C10 H10O3;
,故答案为:C10 H10O3; 或
或 ;
;
(2)反应①的化学方程式为CH3CH(Br)OOCCH3+2NaOH$→_{△}^{水}$CH3COONa+CH3CHO+NaBr+H2O,反应③是乙醛催化氧化生成乙酸,反应化学方程式为:CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,故答案为:CH3CH(Br)OOCCH3+2NaOH$→_{△}^{水}$CH3COONa+CH3CHO+NaBr+H2O; CH3CHO+2Cu(OH)2+NaOH $\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O;
(3)F的分子式为C8H8O2,不饱和度为5,除苯环外还有2个C原子和2个O原子,F的同分异构体,属于酯类且含有苯环的结结构可能有酚羟基与乙酸形成的酯1种,苯甲酸与乙醇形成的酯1种,苯甲醇与甲酸形成的酯1种,酚羟基与甲酸形成的酯基与1个甲基分别处以临间对三个位置,有3种,共有6种,故答案为:6.
点评 本题考查有机物的推断,难度中等,注意计算确定B的分子式,根据有机物的官能团的变化为突破口进行推断,需要学生熟练掌握官能团的结构与性质.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+不一定存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOCH2Cl | B. | ClCH2CH2OH | C. | CH2ClCHO | D. | HOCH2CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.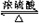 CH3COOC2H5+H2O;反应类型:酯化反应.
CH3COOC2H5+H2O;反应类型:酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com