
| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| (1)实验①和②探究 (2)实验①和③探究 (3)实验①和④探究 |
① | 25℃ | 铝片 | 4.0 |
| ② | 25℃ | 铝片 | 2.0 | |
| ③ | 50℃ | 铝片 | 4.0 | |
| ④ | 25℃ | 铝粉 | 4.0 |
| 1 |
| 100 |
| 1 |
| 100 |


科目:高中化学 来源: 题型:
A、标准状况下,1L庚烷所含有的分子数为
| ||
| B、1mol甲基(-CH3)所含电子数为9NA | ||
| C、标准状况下,C2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | ||
| D、26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
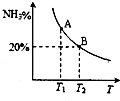 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率%
|
100 | 150 | 200 | ||
| 1 | 19.6 | 27.1 | 36.6 | ||
| 1.5 | a | b | c | ||
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
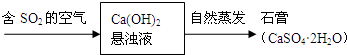

查看答案和解析>>
科目:高中化学 来源: 题型:
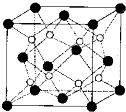 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 喷泉是一种常见的自然现象,其产生原因是存在压强差.
喷泉是一种常见的自然现象,其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
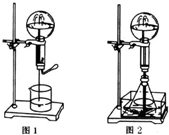
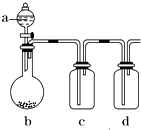 有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用右图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com