
����Ŀ��ƻ������ƻ�����е���Ҫ�������ʡ��������Ի������Ϊԭ�Ϻϳ�ƻ���ᣨ�����ĺϳ�·�ߡ�
�ش��������⣺
��1������������ɻ������ķ�Ӧԭ�������ʿɴ�100%���������Ľṹ��ʽΪ__________________��
��2��ƻ������������������ŵ�������_____________________________________��
��3��д�����������л������ת���ɻ������ķ�Ӧ������____________________��
��4����������ж���ͬ���칹�壬�����뻯����������������ͬ��ֻ��һ�����Ĺ��� ____�֣��������������
��5�������ϳ�·�����漰�ķ�Ӧ������____________________________��
a���ӳɷ�Ӧ b��������Ӧ c��ȡ����Ӧ d����ȥ��Ӧ e����ԭ��Ӧ
��6��д��ƻ������������������Ʒ�Ӧ�Ļ�ѧ����ʽ___________________________��
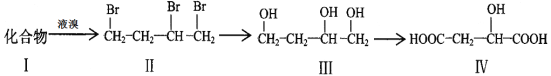
���𰸡�BrCH2CH=CH2 �ǻ� �Ȼ� ����������Һ������ 5 abc ![]()
��������
����������ɻ������ķ�Ӧԭ�������ʿɴ�100%����I��Һ�巢���ӳɷ�Ӧ����II������II�ṹ��ʽ֪��IΪCH2��CHCH2CH2Br��II����ˮ�ⷴӦ����III��III����������Ӧ����IV��
(1)����������ɻ������ķ�Ӧԭ�������ʿɴ�100%��˵���÷�ӦΪ�ӳɷ�Ӧ����II�����ƶ�I��
(2)ƻ�����к����ǻ����Ȼ���
(3)±������ȡ����Ӧ��ҪNaOHˮ��Һ�ͼ��������²��ܷ�����
(4)��������ж���ͬ���칹�壬�����뻯����������������ͬ��˵������̼̼˫������ԭ�ӣ���ֻ��һ������
(5)�ɷ�Ӧǰ��ṹ�仯ȷ����Ӧ���ͣ�
(6)�Ȼ����ǻ����ܺ��Ʒ�Ӧ����������
(1)ͨ�����Ϸ���֪��I�ṹ��ʽΪCH2��CHCH2CH2Br��
(2)ƻ������������������ŵ��������ǻ����Ȼ���
(3)�������ת���ɻ��������±������ˮ�ⷴӦ����Ҫ��NaOH��ˮ��Һ�м��Ƚ��У����Ը÷�Ӧ�ķ�Ӧ����������������Һ�����ȣ�
(4)I�ṹ��ʽΪCH2��CHCH2CH2Br����������ж���ͬ���칹�壬�����뻯����������������ͬ��˵��������ԭ�Ӻ�̼̼˫������ֻ��һ���������̼���ṹΪC��C��C��C����Brֻ�ܷ��ڼ��ϣ���1�֣����̼���ṹΪ![]() ����Br���ڼ��ϣ���1�֣����̼���ṹΪC��C��C��C����3�֣���Br���ܷ��ڼ��ϣ���3�֣��������������5�֣�
����Br���ڼ��ϣ���1�֣����̼���ṹΪC��C��C��C����3�֣���Br���ܷ��ڼ��ϣ���3�֣��������������5�֣�
(5)I��IIΪ�ӳɷ�Ӧ��II��IIIΪˮ�ⷴӦ��ȡ����Ӧ��III��IVΪ������Ӧ�������ϳ�·�����漰�ķ�Ӧ�����мӳɷ�Ӧ��ȡ����Ӧ��������Ӧ���ʴ�Ϊabc��
(6)ƻ����������ǻ����Ȼ�������Na��Ӧ������������ƻ���������������Ʒ�Ӧ�Ļ�ѧ����ʽ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ɡ�λ�������һ���Ʊ���������: ����˵������ȷ����( )
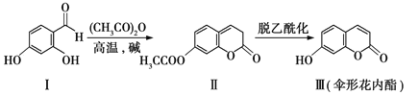
A. ����ܷ���ˮ�ⷴӦ
B. ���������ˮ��Ӧ
C. ���黯��������Ƿ���л��������FeCl3��Һ
D. �뻯�������������ࡢ��Ŀ����ͬ�Һ��б�����ͬ���칹����5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������Ҫ�ҹ㷺��Ӧ��
(1)��̬Fe2+�ļ۲���ӵĹ����ʾʽΪ_____________
(2)����Fe3+������KSCN��Һ��д��SCN-��һ�ֵȵ��������_______��
(3)���ֵ������������±���
Ԫ�� | Mn | Fe | |
������(kJ/mol) |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
���ݱ������ݿ�֪����̬Mn2+ ��ʧȥһ�����ӱ���̬Fe2+ ��ʧȥһ�������ѣ���ԭ����_______________________________________________________
(4)���ɽ���ԭ�ӿ�����CO�����γ����������۵�������������18���ӹ���������Cr������CO�γ�Cr(CO)6 ���ӣ��۵�������(18)= Cr�ļ۵�����(6)+CO�ṩ������(2��6)��Feԭ��Ҳ����CO�γ������仯ѧʽΪ________��
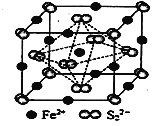
(5)FeS2����ľ�����ͼ��ʾ�������߳�Ϊa nm��FeS2���ʽ��ΪM�������ӵ�������ֵΪNA���侧���ܶȵļ������ʽΪ___________g��cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ag2SO4��KWΪ2.0��10-3��������Ag2SO4��������100 mLˮ�����պñ��ͣ��ù�����Ag+��SO42-Ũ����ʱ��仯��ϵ����ͼ������Ag2SO4��Һ��c(Ag+)��0.034 mol��L-1������t1ʱ����������ϵ�м���100 mL. 0.020 mol��L-1Na2SO4��Һ������ʾ��ͼ�У�����ȷ��ʾt1ʱ�̺�Ag+��SO42-Ũ����ʱ��仯��ϵ���ǣ� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����
A. ͼ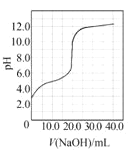 ����������0.1000 mol��L1NaOH��Һ�ζ�20.00 mL 0.1000 mol��L1ijһԪ��HX�ĵζ����ߣ�˵��HX��һԪǿ��
����������0.1000 mol��L1NaOH��Һ�ζ�20.00 mL 0.1000 mol��L1ijһԪ��HX�ĵζ����ߣ�˵��HX��һԪǿ��
B. ͼ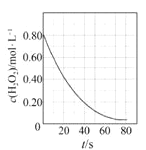 ��������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2 )�淴Ӧʱ��仯�����ߣ�˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
��������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2 )�淴Ӧʱ��仯�����ߣ�˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
C. ͼ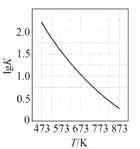 ��CO(g)+H2O(g)
��CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ���ߣ�˵���÷�Ӧ�Ħ�H<0
CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ���ߣ�˵���÷�Ӧ�Ħ�H<0
D. ͼ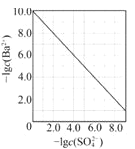 ����������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+ )��c(SO42)�Ĺ�ϵ���ߣ�˵����Һ��c(SO42 )Խ��c(Ba2+ )ԽС
����������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+ )��c(SO42)�Ĺ�ϵ���ߣ�˵����Һ��c(SO42 )Խ��c(Ba2+ )ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
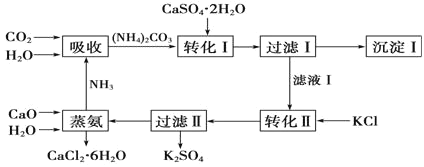
����Ŀ��ʯ��ת��Ϊ����غ�CaCl2�Ĺ���������ͼ��
![]()
��1��CO2��һ�ֺ���Ҫ�ĸ���Ʒ����ҵ�ϻ��CO2��;����___(�û�ѧ����ʽ��ʾ)��
��2�����ˢ�õ�����Һ��___��������Һ�к���CO32���ķ���__��
��3��ת�����з�����Ӧ�Ļ�ѧ����ʽΪ___��ת�����пɻ��K2SO4��ԭ����__��
��4���Ȼ��ƽᾧˮ������Ŀǰ���õ������Ȳ��ϣ�ѡ���������___��
a.�۵�ϵ�(29���ۻ�) b.������
c.�� d.�ܵ���
��5����ˮ�а�������Ҫ��NH4+��NH3��ʽ���ڣ���ȥ���������������ѵ����͵�ⷨ������ⷨ������ǿ��������HClOҲ�ɽ�����ת��Ϊ��������ȥ��ʵ������ʯī�缫���һ��Ũ�ȵ�(NH4)2SO4��NaCl��������Һ��ģ�⡣�����ĵ缫��Ӧʽ___������1mol(NH4)2SO4����Ҫ����HClO���ʵ�����___mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���Ũ��Ϊ0.1 molL��1�����ΪV L�İ�ˮ����μ���һ��Ũ�ȵ����ᣬ��pH�Ʋ���Һ��pH������ļ����������͵ĵζ����ߣ�d��������Һǡ����ȫ��Ӧ������ͼ����Ϣ�ش��������⣺
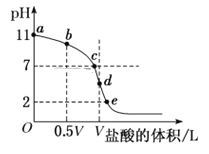
��1�����¶�ʱNH3��H2O�ĵ��볣��K��________��
��2���ζ����������������Ũ��________molL��1��
��3���Ƚ�b��c��d����ʱ����Һ�У�ˮ����̶�����Ϊ___________��(����ĸ)
��4���ζ�ʱ����b�㵽c��Ĺ����У����и�ѡ������ֵ������___(����ĸ����ͬ)��
A�� c(H��)/c(OH��) B��c(H��)��c(NH3��H2O)/c(NH4+)
C��c(NH4+)��c(OH��)/c(NH3��H2O) D��c(H��)��c(OH��)
��5���������ϵζ������ж�����˵����ȷ����______(��Һ��NԪ��ֻ����NH4+��NH3��H2O������ʽ)��
A����b��ʾ��Һ�У�c(NH4+)��c(H��)��c(OH��)��c(NH3��H2O)
B����c��ʾ��Һ�У�c(Cl��)��c(NH3��H2O)��c(NH4+)
C����d��ʾ��Һ�У�c(Cl��)>c(H��)>c(NH4+)>c(OH��)
D���ζ������п����У�c(NH3��H2O)>c(NH4+)>c(OH��)>c(Cl��)>c(H��)
��6��d��֮������������������ͼ���е�e��(������NH4+ˮ���Ӱ��)����e���Ӧ�ĺ�����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2SO2+ O2![]() 2SO3�ﵽƽ��ı�־��
2SO3�ﵽƽ��ı�־��
������2 mol SO2��ͬʱ����2 mol SO3
�� SO2��O2��SO3�����ʵ���֮��Ϊ2��1��2
����Ӧ������У�SO3�������������ٸı�
A.�٢�B.�٢�C.ֻ����D.ֻ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com