
【题目】13.在密闭容器中一定量混合气体发生反应:xA(g)+yB(g) ![]() zC(g)平衡时测得A的浓度为0.5 mol·L-1 , 保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1 , 下列判断正确的是( )
zC(g)平衡时测得A的浓度为0.5 mol·L-1 , 保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol·L-1 , 下列判断正确的是( )
A.平衡向正反应方向移动
B.x+y>z
C.C的体积分数保持不变
D.B的转化率降低
【答案】A
【解析】由信息可知,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时测得A的浓度为0.20mol/L,体积增大,相当于压强减小,化学平衡正向移动,则
A.由上述分析可知,平衡正向移动,A符合题意;
B.减小压强,向气体体积增大的方向移动,则x+y<z,B不符合题意;
C.平衡正向移动,C的体积分数增大,C不符合题意;
D.平衡正向移动,B的转化率增大,D不符合题意。
所以答案是:A
【考点精析】本题主要考查了化学平衡移动原理以及影响因素的相关知识点,需要掌握影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动才能正确解答此题.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用下列装置不能达到有关实验目的是( )

A. 用甲图装置证明ρ(煤油)< ρ(钠)< ρ(水)
B. 用乙图装置可以吸收氨气防止倒吸
C. 用丙图装置制取金属锰
D. 用丁装置比较NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是____。
(2)以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。

①实验前,要将铝土矿粉粹的目的是_______。
②用氧化物的形式表示铝硅酸钠的化学式________。
③步骤②涉及到的离子方程式是: _______。
④写出利用Al2O3制备金属Al的化学方程式: _______。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系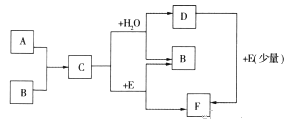
(1)写出A、B、E的化学式:
A , B , E。
(2)完成下列化学反应方程式:
①C+H2O:。
②D+E:。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验。下列说法正确的是( )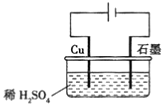
A.电解过程中,铜极上有H2生成
B.电解初期,主反应方程式为:2H2O=H2↑+O2↑
C.整个电解过程中,H+的浓度不断增大
D.电解一定时间后,石墨电极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3 , 放出92kJ热量。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究____________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________作对比(填序号)。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液 ③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸 ⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂________(填序号),现象______________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
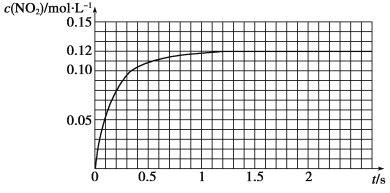
(1)反应容器中最后剩余的物质有______________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。( )
HIn(溶液) ![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是
A.①③⑤
B.②⑤⑥
C.①④
D.②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com