
 ;
;
分析 烃A的相对分子质量为84,则$\frac{84}{14}$=6,烃A分子中含有一个碳碳双键,则A属于烯烃,分子式为C6H12,分子中只有一种类型的氢原子,双键C原子上的4个H均被甲基取代,则A为 .
.
解答 解:(1)烃A的相对分子质量为84,则$\frac{84}{14}$=6,烃A分子中含有一个碳碳双键,则A属于烯烃,分子式为C6H12,分子中只有一种类型的氢原子,则烃A为对称结构,双键C原子上的4个H均被甲基取代,则A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)乙烯为平面结构,所有原子处于同一平面,而 中甲基中C原子处于乙烯中H原子位置,故所有碳原子都处于同一平面,故答案为:是;
中甲基中C原子处于乙烯中H原子位置,故所有碳原子都处于同一平面,故答案为:是;
(3)A在酸性高锰酸钾的氧化作用下生成的产物的结构简式为: ,故答案为:
,故答案为: ;
;
(4)除A之外与A同类的主链上四个碳原子的所有同分异构有:CH2=C(CH2CH3)2、CH2=CHC(CH3)3,CH2=C(CH3)CH(CH3)2,
故答案为:CH2=C(CH2CH3)2、CH2=CHC(CH3)3,CH2=C(CH3)CH(CH3)2.
点评 本题考查有机物分子式的确定,难度不大,侧重于学生的分析能力的考查,注意把握同分异构体的书写.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将64g铜片投人过量浓硫酸中(铜片) | |
| B. | 向含有0.2molBa(OH)2和O.lmolNaOH的混合溶液中通人标况下3.36LCO2(CO2) | |
| C. | 向lOmL3mol•L-1的盐酸中加人5.6g铁(铁) | |
| D. | 向5.5gMn02粉末中加人20mL2mol•L-1双氧水(Mn02) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
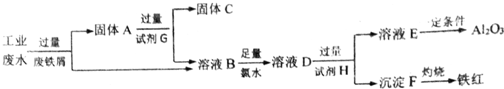
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8、C4H8、C4H6 | B. | CH4、C3H6、C2H2 | C. | C2H6、C3H6、C4H6 | D. | C2H4、CH4、C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
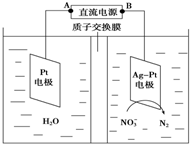
| A. | 铅蓄电池的B极为正极,电极材料为PbO2 | |
| B. | 铅蓄电池工作过程中负极质量增加 | |
| C. | 该电解池的阳极反应为:2 NO3-+6H2O-10e-═N2↑+12OH- | |
| D. | 若电解过程中转移10mol电子,则生成N2的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与水反应时,生成0.1mol氧气,转移电子数为0.2NA | |
| B. | 2L 0.5mol•L-1亚硫酸溶液中,含有的H+离子数为2NA | |
| C. | 常温常压下,1mol氦气含有的原子数为2NA | |
| D. | 标准状况下,11.2L水含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com