

分析 (1)得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
(2)还原剂对应的产物是氧化产物;
(3)根据氧化剂和转移电子之间的关系式计算;
(4)根据化合价的升降判断参加氧化还原反应的反应物和生成物,然后根据元素守恒判断未参加氧化还原反应的反应物和生成物;
根据化合价 的升降判断电子的转移方向,根据得失电子的最小公倍数确定转移的电子数.
解答 解:(1)向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色,则反应过程中有碘生成,同时说明铜离子、碘酸根离子得电子发生还原反应,则Cu(IO3)2作氧化剂,碘化钾中碘离子失电子作还原剂,
故答案为:Cu(IO3)2;
(2)还原剂碘离子失电子对应的产物I2是氧化产物,故答案为:I2;
(3)根据氧化剂和转移电子之间的关系式得转移电子的物质的量=1mol×[(2-1)+(5-0)×2]=11mol,
故答案为:11mol;
(4)该反应中NaBiO3是反应物,根据Bi元素守恒,Bi2(SO4)3是生成物,Bi元素由反应物到生成物,化合价降低,所以NaBiO3是氧化剂;NaMnO4中锰元素的化合价是+7价,MnSO4中锰元素的化合价是+2价,要选取还原剂,只能是化合价由低变高,所以MnSO4作还原剂,NaMnO4是氧化产物;再根据元素守恒,反应物中还有硫酸,产物中还有Na2SO4和H2O;
该反应中,NaBiO3是氧化剂,MnSO4作还原剂;MnSO4→NaMnO4,锰元素由+2价→+7价,一个MnSO4失去5个电子;NaBiO3→Bi2(SO4)3,Bi元素由+5价→+3价,生成一个Bi2(SO4)3,需得4个电子,所以其得失电子的最小公倍数为20,则其化学反应方程式为10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O
.
故答案为:10NaBiO3+4MnSO4+14H2SO4=5Bi2(SO4)3+4NaMnO4+3Na2SO4+14H2O;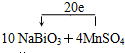 .
.
点评 本题考查了氧化剂、氧化产物的判断、氧化还原反应方程式的配平,明确元素化合价是解本题关键,注意(1)题的氧化剂中有两种元素得电子,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | X和Y的转化率不一定相等 | B. | n1、n2=2:1 | ||
| C. | 平衡时,Y和Z的生成速率之比为2:1 | D. | n,的取值范围为0<n1<0.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
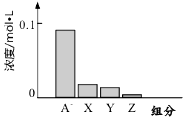 常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中都分微粒组分及浓度如图所示,下列说法正确的是( )| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据物质能否导电,可以将化合物分为电解质和非电解质 | |
| B. | 根据氧化物中是否含有金属元素,可以将氧化物分为碱性氧化物和酸性氧化物 | |
| C. | 根据组成元素的种类,将纯净物分为单质和化合物 | |
| D. | 根据分散系的稳定性大小,可以将分散系分为胶体、浊液和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池就是将氢气在氧气中燃烧,从而获得电流 | |
| B. | 46g的乙醇和28g的乙烯完全燃烧时消耗的O2均为为67.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数一定也为7 | |
| D. | Cl-的结构示意图为 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com