
| A. |  滴加液体药品 | B. |  过滤 | C. | 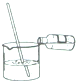 稀释浓硫酸 | D. |  读取液体的体积 |
分析 A.用胶头滴管滴加液体,滴管注意不要接触试管.
B.过滤液体时,注意“一贴、二低、三靠”的原则;
C.稀释浓硫酸时注意防止酸液飞溅;
D.根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断.
解答 解:A.使用胶头滴管滴加少量液体的操作,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作正确,故A正确;
B.过滤液体时,要注意“一贴、二低、三靠”的原则,图中缺少玻璃棒引流,图中所示操作错误,故B错误;
C.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中,故C正确;
D.量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中所示操作正确,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离、提纯以及溶液的稀释、量取等操作,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.


科目:高中化学 来源:2017届江苏省南通市如东县徐州市丰县高三10月联考化学卷(解析版) 题型:选择题
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
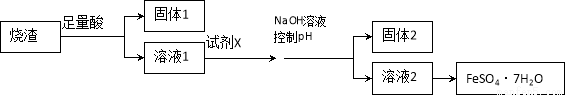
下列说法不正确的是
A.溶解烧渣选用足量硫酸,目的是提高浸出率
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次联考化学试卷(解析版) 题型:选择题
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X 的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是()
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于15% | B. | 大于15% | C. | 小于15% | D. | 无法估算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com