
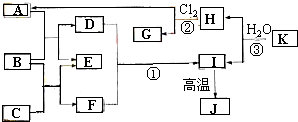
 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出). .
.分析 H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;
J是耐高温材料,是I高温分解产物则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒和化合价代数和为0,可知K为Al4C3,再结合题目分析解答.
解答 解:H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;
J是耐高温材料,是I高温分解产物则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒和化合价代数和为0,可知K为Al4C3,
(1)B为铝,铝元素位于周期表中第三周期第ⅢA族,分析可知K为Al4C3,
故答案为:第三周期第ⅢA族;Al4C3 ;
(2)反应①是氯化铝和偏铝酸钠混合双水解促进反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O=4 Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4 Al(OH)3↓;
(3)将D为氯化铝溶液,存在水解平衡,AlCl3+3H2O?Al(OH)3+3HCl,溶液蒸干促进水解平衡正向进行,得到氢氧化铝固体,将所得的固体物质灼烧得到氧化铝,为避免氯化铝水解,可以在干燥的氯化氢气流中加热蒸干氯化铝溶液得到氯化铝固体,
故答案为:Al2O3; 在干燥的氯化氢气流中加热蒸干;
(4)反应②是甲烷的取代反应,进行的条件通常是光照,CH2Cl2电子式为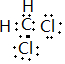
故答案为:光照;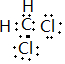 ;
;
(5)J与焦炭在高温的情况下可以生成K和二氧化碳,反应的化学方程式为:2Al2O3+6C=Al4C3+3CO2,反应中氧化剂与还原剂为碳,氧化剂与还原剂的质量之比为 1:1,
故答案为:2Al2O3+6C=Al4C3+3CO2; 1:1;
点评 本题以Al、Cl及其化合物为载体考查了无机物推断,涉及离子方程式书写、物质结构等知识点,以分子结构、物质用途、物质性质为突破口进行推断,以碳化钙和水反应生成乙炔为例采用知识迁移的方法推断K物质,题目难度中等.


科目:高中化学 来源: 题型:解答题
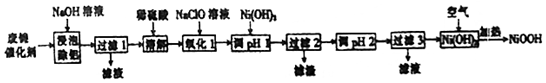
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
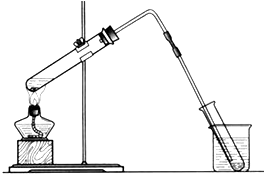 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热为285.8 KJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
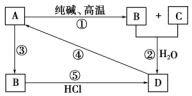 已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.
已知A是一种装饰品的主要成分,根据如图转化关系,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
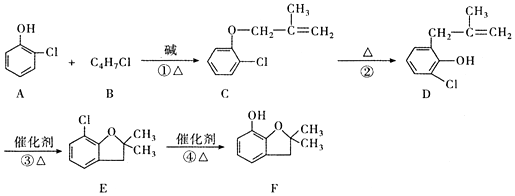
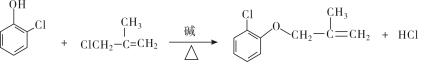 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com