
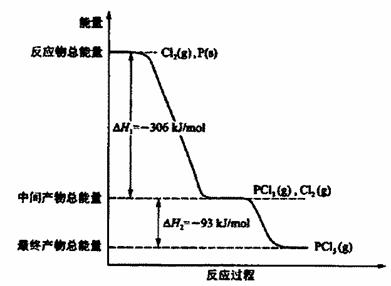
 ,由于正反应是吸热反应,所以升高温度,平衡向正反应方向移动,PCl5的分解率增大,即α2大于α1。
,由于正反应是吸热反应,所以升高温度,平衡向正反应方向移动,PCl5的分解率增大,即α2大于α1。

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | F2 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 157 | 243 | 194 | 153 | 436 | 568 | 432 | 366 | 299 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应热指的是反应过程中吸收或放出的能量 |
| B.热化学方程式的化学计量数可表示分子的个数 |
| C.在热化学方程式中无论反应物还是生成物均必须标明聚集状态 |
| D.所有的化学反应均伴随能量变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL 0.55mol.L-1NaOH | 50mL 0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·
 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·
 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·
 =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ·
| A.a<c <0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.自发反应在恰当条件下才能实现 |
| B.所有的化学反应都有能量变化 |
| C.升高温度,活化分子百分数增大,化学反应速率一定增大 |
| D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.正反应为吸热反应 |
| B.正反应为放热反应 |
| C.加入催化剂,该化学反应的反应热增大 |
| D.从图中可看出,该反应的反应热与反应途径有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com