
| A. | 原子半径:C>A | |
| B. | 离子半径:D3+>B2- | |
| C. | 非金属性:A>B | |
| D. | 最高价氧化物对应水化物的碱性:C<D |
分析 A、B、C、D为四种短周期主族元素,且原子序数依次增大.B是地壳中含量最高的元素,则B为O元素,A的最外层电子数是其电子层数的2倍,A为第二周期元素,则A的最外层电子数为4,可知A为C元素;C原子最外层只有一个电子,C的原子序数大于8,可知C为Na元素;B原子的最外层电子数是D原子最外层电子数的2倍,D的最外层电子数为3,为第三周期的Al元素,然后结合元素周期律来解答.
解答 解:A、B、C、D为四种短周期主族元素,且原子序数依次增大.B是地壳中含量最高的元素,则B为O元素,A的最外层电子数是其电子层数的2倍,A为第二周期元素,则A的最外层电子数为4,可知A为C元素;C原子最外层只有一个电子,C的原子序数大于8,可知C为Na元素;B原子的最外层电子数是D原子最外层电子数的2倍,D的最外层电子数为3,为第三周期的Al元素,
A.电子层越多,原子半径越大,则原子半径:C>A,故A正确;
B.具有相同电子排布的离子中原子序数大的离子半径小,则离子半径:D3+<B2-,故B错误;
C.同周期从左向右非金属性增强,则非金属性:A<B,故C错误;
D.金属性Na>Al,则最高价氧化物对应水化物的碱性:C>D,故D错误;
故选A.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯塑料制品可用于食品的包装 | |
| B. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量 | |
| C. | 原电池放电发生化学变化,同时能量发生转化 | |
| D. | 开发太阳能,推广使用甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 200 mL | C. | 300 mL | D. | 400 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解)
往含0.2mol NaOH和0.1mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol.请以CO2的量为横坐标,以溶液中离子的总量为横坐标,画出离子总量随CO2加入量变化的折线图.(不计弱电解质的电离和盐的水解)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | PbSO4 | PbCO3 | PbS |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
| A. | 碳酸盐 | B. | 硫酸盐 | C. | 硫化物 | D. | 以上沉淀剂均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、不锈钢、硬铝都是合金 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 铜与O2反应,生成黑色的Cu2O | |
| D. | CuSO4•5H2O是一种混合物,加热后变为白色粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
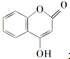 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: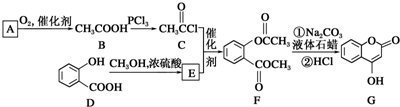
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com