
【题目】Ⅰ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | a | 2.0 | 2.0 | 5.2 |
3 | 3.0 | b | 2.0 | 1.0 | 6.4 |
(1)a=________,b=__________.根据上表中的实验数据,该组实验的结论_____________。
(2)①该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

该小组同学提出的假设是___________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是__________。
③若该小组同学提出的假设成立,时间t__________4.0min(填>、=或<)。
Ⅱ.某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母abcdef...表示)。
物理量 实验序号 | V/mL[0.1 mol·L-1 Fe2(SO4)3] | ||||
1 | a | ||||
2 | a |
________________________。
【答案】a=3 b=4 条件相同时,增大H2SO4浓度反应速率增大 生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) MnSO4 <
物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | V[H2O2]/mL | V[H2O]/mL | 时间/s | V[O2] /mL |
1 | a | b | c | e | d |
2 | a | c | b | e | f |
【解析】
Ⅰ(1)根据表中数据,探究的外界条件为硫酸的浓度对反应速率的影响,则必须满足除浓度改变外,其他条件不变,溶液的总体积不变;
(2)①由图2可知,反应开始后反应速率加快,则说明生成的硫酸锰为反应的催化剂;
②与上述实验做对比,只改变硫酸锰的量,而其他条件相同;
③若锰离子为催化剂时,反应速率加快,使用的时间缩短,则t<4.0min;
Ⅱ.探究H2O2浓度对H2O2分解反应速率的影响,可通过测量相同时间内生成氧气的体积进行判断。
Ⅰ.(1)根据表中数据,探究的外界条件为硫酸的浓度对反应速率的影响,则必须满足除浓度改变外,其他条件不变,溶液的总体积不变,即10.0mL,可判断a=3.0mL,b为4.0mL;
(2)①由图2可知,反应开始后反应速率加快,则说明生成的硫酸锰为反应的催化剂,则提出的假设为生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用);
②与上述实验做对比,只改变硫酸锰的量,而其他条件相同,则固体X为硫酸锰;
③若锰离子为催化剂时,反应速率加快,使用的时间缩短,则t<4.0min;
Ⅱ.探究H2O2浓度对H2O2分解反应速率的影响,可通过测量相同时间内生成氧气的体积进行判断,需要除H2O2的浓度不同之外,则其他条件完全相同,即相同浓度的Fe3+的催化剂,因量取H2O2的体积不同,则加入水的体积与H2O2的体积和相同。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:![]() 三氯化氮
三氯化氮![]() 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量![]() ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量![]() ,该反应的化学方程式为______。
,该反应的化学方程式为______。![]() 一定条件下,不同物质的量的
一定条件下,不同物质的量的![]() 与不同体积的
与不同体积的![]() 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
反应序号 | n | V | 放出的热量 |
1 |
|
| A |
2 |
|
| b |
该条件![]() 与NaOH 溶液反应生成
与NaOH 溶液反应生成![]() 的热化学反应方程式为______。
的热化学反应方程式为______。![]() 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为:![]() ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温![]() 温度分别为
温度分别为![]() 、
、![]() 容器中分别加入
容器中分别加入![]() 和
和![]() ,测得各容器中
,测得各容器中![]() 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
| 0 | 40 | 80 | 120 | 160 |
|
|
|
|
|
|
|
|
|
|
|
|
![]() 甲容器中,
甲容器中,![]() 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率![]() ______。
______。![]() 该反应的
该反应的![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______![]() 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不”![]() 移动。
移动。![]() 常温下,在
常温下,在![]() 溶液中,反应
溶液中,反应![]() 的平衡常数
的平衡常数![]() ______。
______。![]() 已知常温下,
已知常温下,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]()
![]() 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将![]() 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示

![]() 太阳能电池的负极是______
太阳能电池的负极是______![]() 填“a”或“b”
填“a”或“b”![]()
![]() 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的盐酸滴入20.00mL0.10mol·L-1氨水中,溶液的pH和pOH随加入盐酸体积的变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法不正确的是( )

A.M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B.N点所示溶液中c(NH4+)<c(Cl-)
C.Q点消耗盐酸的体积小于氨水的体积
D.M点和N点水的电离程度均小于Q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
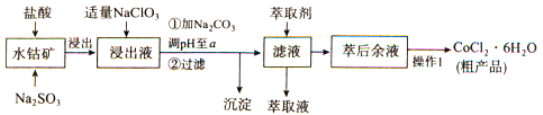
已知:①浸出液含有的阳离子主要有H+、CO2+、Fe2+、Mn2+、Al3+等;
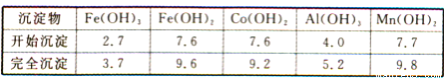
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式:_______________。
(2)若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式:_______________。
(3)“操作1”中包含3个基本实验操作,它们依次是_____________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________。
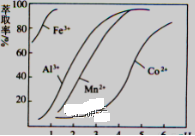
(4)萃取剂对金属离子的萃取率与pH的关系如图向“滤液”中加入萃取剂的目的是____________,其使用的最佳pH范围是______。
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(注:横坐标依次为1-6;单位:PH)
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是__________。(答一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为_____。
(2)工业上用CO2和H2反应合成二甲醚。
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ/mol
CH3OCH3(g)+H2O(g)=2CH3OH(g) △H2=+23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的n(CO2)/n(H2)值变小
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者之间的大小关系为_________。

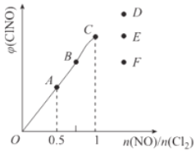
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),2NO(g)+Cl2(g)![]() 2ClNO(g),平衡时ClNO的体积分数的变化图像如图,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
2ClNO(g),平衡时ClNO的体积分数的变化图像如图,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)向Na2S2O3溶液中加入稀硫酸。_______________
(2)含有KI、H2SO4和淀粉的溶液,通入氧气后溶液变蓝__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法, 错误的是
A.氢氟酸盛装在细口玻璃瓶中
B.氢氧化钠溶液装在用橡胶塞的试剂瓶中
C.硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中
D.金属钠保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com