
�Ӵ��������Ṥ���У�������Ӧ��450�沢�д��������½��У�
2SO2(g) + O2(g)  2SO3(g)
2SO3(g)  H=��197 kJ/mol
H=��197 kJ/mol
����˵����ȷ����
A��ʹ�ô����������SO2��ת����
B������O2��Ũ�ȿ�����߷�Ӧ���ʺ�SO2��ת����
C����Ӧ450��ʱ��ƽ�ⳣ��С��500��ʱ��ƽ�ⳣ��
D��2 mol SO2(g) ��1 mol O2(g)��������������2 mol SO3(g) ������������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����֪���ʵ���Ũ�ȵ�NaOH��Һ�ⶨδ֪���ʵ���Ũ�ȵ����ᣬ������������
A����ʽ�ζ������ô���������ϴ
B����ʽ�ζ��ܲ��ñ���Һ��ϴ
C���ζ������в�����Һ�����ƿ����
D���ζ�����������ʱҪƽ�Ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������µ��ܱ������У�4NH3��g����5O2��g�� 4NO��g����6H2O��g������H=��3623kJ·mol��1������������ȷ���� �� ��
4NO��g����6H2O��g������H=��3623kJ·mol��1������������ȷ���� �� ��
A�����ܱ������г���4molNH3������������ַ�Ӧ���ﵽƽ��ʱ�ų�����Ϊ3623KJ
B��ƽ��ʱv����O2��= 4/5 v�棨NO��
C��ƽ��������¶ȣ����������NO��������
D��ƽ���ѹǿ���������ƽ��Ħ��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10mLһ�����ʵ���Ũ�ȵ������еμ�һ�����ʵ���Ũ�ȵ�NaOH��Һ����pH�仯����ͼ��ʾ��������Һ�����ʵ���Ũ�ȷֱ���
| A | B | C | D | |
| ��������ʵ���Ũ�� mol/L | 0��12 | 0��04 | 0��03 | 0��09 |
| NaOH�����ʵ���Ũ�� mol/L | 0��04 | 0��12 | 0��09 | 0��03 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����
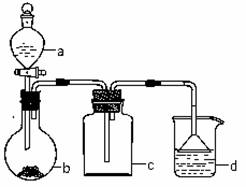
| ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
| A | Ũ��ˮ | NaOH | NH3 | H2O |
| B | Ũ���� | Na2SO3 | SO2 | NaOH��Һ |
| C | ϡ���� | Cu | NO2 | H2O |
| D | ����ʳ��ˮ | CaC2 | C2H2 | KMnO4������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������ѧ��ѧ�г��������壬����;�㷺��
��1��ʵ������ȡ�����Ļ�ѧ����ʽ�� ��
|

|

|

 |
�� �÷�Ӧ���Ȼ�ѧ����ʽ�� ��
�� �����¶ȵ����ߣ��÷�Ӧ�Ļ�ѧƽ�ⳣ���ı仯������ ��
�� һ���¶��£�2 L�ܱ������У�5 molN2��5 molH2������Ӧ���ﵽƽ��ʱ��N2��ת����Ϊ20%�����¶��·�Ӧ��ƽ�ⳣ������ֵ�� ������ĸ����
�� ����һ�ּ�鰱���Ƿ�й¶�ɲ��õĻ�ѧ������ ��
��3����ҵ�������β���к��϶��SO2��Ϊ��ֹ��Ⱦ��������������SO2����ҵ�ϳ��ð�ˮ���շ�����β����
�� ����ˮ�������������ʵ���Ϊ3 mol �����ձ�״����44.8 L SO2ʱ����Һ�е�����Ϊ ��
�� (NH4)2SO3�Լ��ԣ��û�ѧƽ��ԭ������ ��
�� NH4HSO3�����ԡ��ð�ˮ����SO2��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ���� ������ĸ����
a��c(NH4��) = 2c(SO32��) �� c(HSO3��)
b��c(NH4��)> > c(SO32-)> c(H+)= c(OH-)
c��c(NH4��)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
��4��������һ�ָ���ȼ�ϣ�����ֱ������ȼ�ϵ�أ���ͼ�ǹ���ˮʽȼ�ϵ�ع���ԭ����

�� ����ȼ�ϵ�صĵ������Һ���ѡ�� ������ԡ��������ԡ������ԡ�����Һ��
�� �����ڽ�����װ��ǰ��Ҫͨ����������ȥ�������� ��
�� ����ȼ�ϵ�صķ�Ӧ�ǰ�������������һ�ֳ������������ˮ���õ�صĵ缫�ܷ�Ӧ�� �������ĵ缫��Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���鰱����ѡ�ã�������
��������A��ʪ�����ɫʯ����ֽ����������B������ĺ�ɫʯ����ֽ
��������C���������ɫʯ����ֽ����������D��ʪ��ĺ�ɫʯ����ֽ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йذ���ӵ�����(NA)��˵����������
A��32��O2������ԭ����ĿΪNA B��0.5 molH2O���е�ԭ����ĿΪ1.5 NA
C��1 molH2O���е�H2O������ĿΪNA D��0.5 mol�������еķ�����ĿΪ0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������F��һ����Ҫ���л��ϳ��м��壬���ĺϳ�·�����£�
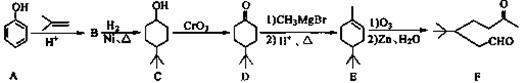
��1��������F�к��������ŵ������� �� �� �� ��
��B����C�Ļ�ѧ��Ӧ������ �� ��
��2��д��������C�����ᷴӦ�������Ļ�ѧ����ʽ�� �� ��
��3��д��������B�Ľṹ��ʽ�� �� ��
��4��ij��������D��ͬ���칹�壬�ҷ�����ֻ�����ֲ�ͬ��ѧ�������⡣д���û�
����Ľṹ��ʽ�� �� ����дһ�֣���
��5�����������֪ʶ����������Ϣ��д���Ա��ӣ�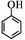 ����CH2��CH2Ϊԭ���Ʊ�
����CH2��CH2Ϊԭ���Ʊ�
 |
�л��� �ĺϳ�·������ͼ�����Լ����ã���
|

|
|
 H2C== CH2
H2C== CH2 CH3CH2Br CH3CH2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com