
����Ŀ����ͼ��Ԫ�����ڱ���һ������

��1��Ԫ����ԭ�ӽṹʾ��ͼΪ__________��
��2��Ԫ���ۢ��ĵ�һ�����ܴ�С��ϵΪ_______���ѧ�����ͬ����ԭ����__________________����-��������������Ӧˮ����������ǿ����_______��
��3��д��Ԫ�����������������NaOH��Һ��Ӧ�����ӷ���ʽ_________��
��4��Ԫ�آ� ��� Ԫ����ȣ��ǽ����Խ�ǿ����__________(��Ԫ�ط��ű�ʾ)�����б�������֤����һ��ʵ����__________��
A����̬�⻯��Ļӷ��Ժ��ȶ���
B����Ԫ�صĵ縺��
C�����ʷ����еļ���
D�������������
E���⻯����X��H���ļ���
F������������Ȼ���еĴ�����ʽ
��5��������������Ԫ�صĵ�һ�����ĵ��������ݣ���λ��KJ��mol��1�����ش�������⣺
Ԫ�ش��� | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
��TԪ���������________������s������p������d������ds���ȣ���Ԫ�أ�
�����ڱ��У�����ܴ���ͬһ�������_________������Ԫ�ش��ţ���
���������ӵ���������������______________��
A.S2+ B��R2+ C��U+ D��T3+
���𰸡�  O<N N��2P������ڰ�������ȶ� HClO4 Al2O3��2OH��===2AlO
O<N N��2P������ڰ�������ȶ� HClO4 Al2O3��2OH��===2AlO![]() ��H2O F BE p R ��U C
��H2O F BE p R ��U C
����������Ԫ�������ڱ���λ��,����֪����ΪC����ΪBe����ΪN����ΪO����ΪF����ΪNa����ΪAl����ΪCl����ΪTi����ΪFe��
��1��Ԫ�آ�Ϊ�����˵����Ϊ26��ԭ�ӽṹʾ��ͼ  ����ȷ����
����ȷ���� ��
��
��2����ΪN����ΪO���ǽ�����Խǿ����һ������Խ�����ڵ�Ԫ�ص�2p������Ӵ��ڰ����״̬���ȶ���ǿ����һ�����ܱȽϴ���ΪO����ΪF����ΪNa����ΪAl����ΪCl�����ڷ�Ԫ��û�����ۣ������Ԫ�ص�����������Ӧˮ����������ǿ����ѧʽΪHClO4����ȷ�𰸣�O<N ��N��2P������ڰ�������ȶ���HClO4��
��3��Ԫ�آߵ����������Ϊ����������������������Һ��Ӧ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽ��Al2O3��2OH��===2AlO![]() ��H2O����ȷ����Al2O3��2OH��===2AlO
��H2O����ȷ����Al2O3��2OH��===2AlO![]() ��H2O��
��H2O��
��4��Ԫ�آ�Ϊ�� ����Ϊ����ͬһ������ϵ������ǽ����Լ�������˷ǽ����Խ�ǿ����F ����̬�⻯��Ļӷ���Ϊ�������������ǽ���ָ���ǻ�ѧ������A����ͬһ���壬���ϵ��£��縺�Լ������ǽ����Լ���������֤�����ۣ�B��ȷ����Ϊ��ԭ�Ӱ뾶̫С��ԭ�Ӻ�֮��ij����ϴ��·�ԭ�Ӽ���ܽ�С����˲���ͨ�����ʷ����еļ��ܴ�С�ж϶�Ԫ�صķǽ����Ե�ǿ����C����Ԫ�������ۣ�û����ۺ����ᣬ����֤�����ۣ�D�������⻯����X��H���ļ������⻯���ȶ���Խ��ǽ�����Խ��������֤�����ۣ�E��ȷ������������Ȼ���о��Ի���̬������ʽ���������������ܱȽϷǽ���ǿ����F������ֻ��BE������������ȷѡ��BE��
��5����Q�ĵ����ܽϴ�,�����һ�����ܽϴ�,Ӧ��Ϊϡ������Ԫ����R��һ������ԶԶС�ڵڶ�������,��RԪ��ԭ������������Ϊ1,���ڵ�IA��Ԫ���� S�ڶ�������ԶԶС�ڵ���������,��SԪ��ԭ��������������2,���ڵ�IIA��Ԫ���� TԪ�ص���������ԶԶС�ڵ��ĵ�����,��TԪ��ԭ��������������3,���ڵ�IIIA��Ԫ���� UԪ�ص�һ������ԶԶС�ڵڶ�������,��UԪ��ԭ��������������1,���ڵ�IA��Ԫ�أ��������Ϸ�����֪��T�ĵ�һ���ڶ������������ܽ�С,����������Ϊ3,��TԪ���������p��Ԫ�أ�R��U�ĵ�һ�����ܽ�С,����������Ϊ1,����λ��ͬһ��������ȷ�� ��p��R ��U��
��������ָ�������ʵõ������������ӵ��������������䵥�ʵĻ�ԭ����ǿ����˾����ϵ��������ݷ�����֪��RΪ����UΪ����SΪþ��TΪ�����⼸��Ԫ���γɵĽ��������У�������ǿ��Ϊ�أ����������ӵ�������������C��ȷ����ȷѡ��C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(CeO2)��һ����Ҫ��ϡ��������Է�̼���(��Ҫ��CeCO3F)Ϊԭ���Ʊ�CeO2��һ�ֹ����������£�
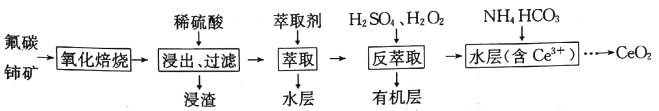 ��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��֪��i.Ce4+����F����ϳ�[CeFx](4-x)+��Ҳ����SO42-��ϳ�[CeSO4]2+��
��.��������ϵ��Ce4+�ܱ���ȡ��[(HA)2]��ȡ����Ce3+����
��.�����£�Ce2(CO3)3������ҺŨ��Ϊ1.0��10-6mol��L-1��
�ش��������⣺
��1�������������������п��Լӿ췴Ӧ���ʺ����ԭ�������ʵķ�����__________��__________ (д��2�ּ���)��
��2��д������������������CeO2��ϡH2SO4��Ӧ�����ӷ���ʽ��__________��
��3������ȡ��ʱ���ڷ�Ӧ��Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=
Ce(H2n-4A2n)+4H+��D��ʾCe4+�ֱ����л�������ˮ���д�����ʽ��Ũ��֮��(D=![]() )�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
)�����������������䣬����ʼ��Һ�м��벻ͬ����Na2SO4�Ըı�ˮ���е�c(SO42-)��D����ʼ��Һ��c(SO42-)�������С��ԭ����_____________��
��4�������������ɵ�Ce(BF4)3������KCl��Һ�������·�Ӧ��
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)��
3KBF4(s)+ Ce3+(aq)��
��һ���¶�ʱ��Ce(BF4)3��KBF4��Ksp�ֱ�Ϊa��b����÷�Ӧ��ƽ�ⳣ��K=__________(��a��b��ʾ)��
��5��������ȡ���м�H2O2����Ҫ��Ӧ���ӷ���ʽΪ__________����������ȡ��������ˮ���м���1.0mol��L-1��NH4HCO3��Һ������Ce2(CO3)3��������Ce3+������ȫʱ[c(Ce3+)=1��10-5mol��L-1]����Һ��c(CO32-)ԼΪ__________��
��6��CeO2������β�����������Ĺؼ��ɷ֣������ڻ�ԭ�����й����������������к�������β�����������з�����CeO2![]() CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
CeO2(1-x)+xO2��(0��x��0.25)��ѭ����д��CeO2����COβ���Ļ�ѧ����ʽ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���ֵ��ʾ�й�Ԫ�ص�ԭ��������������ʾ�ĸ�ԭ�����������ϳ�AB2���ȶ����ۻ�������ǣ� ��
A.18��12
B.7��8
C.11��16
D.12��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�صĻ�̬ԭ�ӵĵ����Ų�ʽ���£���1s22s22p63s23p2����1s22s22p63s23p3����1s22s22p4����1s22s22p3���������йرȽ�����ȷ����(����)
A. �縺�ԣ���������������
B. ԭ�Ӱ뾶����������������
C. ��һ�����ܣ���������������
D. ��������ϼۣ�������=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij���л���Ľṹ����������������������ȷ����
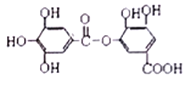
A. 1mol���л�����һ�������£�����7molH2�����ӳɷ�Ӧ
B. ����NaHCO3��Ӧ�ų�����
C. ������FeCl3��Һ���÷�����ɫ��Ӧ
D. 1mol���л�����һ�������£�����7molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У�����Ҫ�ƻ���ѧ�����ǣ� ��
A.�Ȼ�������ˮ
B.���������ʹ��ֽ�
C.������
D.�Ȼ����ۻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ��������ܣ�������һ����Ҫ�������ԭ�ϣ�ʵ�����Ʊ�ʵ���������£�
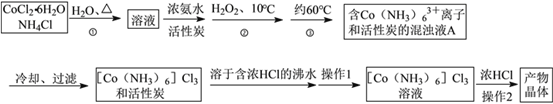
��֪��[Co(NH3)6]Cl3��ˮ�е���Ϊ[Co(NH3)6]3����Cl����[Co(NH3)6]Cl3���ܽ�����±���
�¶ȣ��棩 | 0 | 20 | 47 |
�ܽ�ȣ�g�� | 4.26 | 6.96 | 12.74 |
��1���ڢٲ��������NH4Cl��Һ�м�����ϸ��CoCl2��6H2O���壬�����������ϸ��Ŀ����__
��2��ʵ�����Ʊ����Ȼ���������(III)�Ļ�ѧ����ʽΪ��____________
��3��ʵ�����1Ϊ _________[Co(NH3)6]Cl3��Һ�м���Ũ�����Ŀ����_____
��4���ֳ�ȡ0.2675g[Co(NH3)6]Cl3����Է�������Ϊ267.5������A�з������·�Ӧ��[Co(NH3)6]Cl3��3NaOH![]() Co(OH)3��+6NH3��+3NaCl��װ�ü�����ͼ����C��װ0.5000mol��L��1������25.00mL��D��װ�б�ˮ��������ƿ��ʹNH3��ȫ�ݳ�������������ˮ��ϴ�����¶������ճ������Һ��C�У�����2��3�μ���ָʾ������0.5000mol��L-1��NaOH�ζ���
Co(OH)3��+6NH3��+3NaCl��װ�ü�����ͼ����C��װ0.5000mol��L��1������25.00mL��D��װ�б�ˮ��������ƿ��ʹNH3��ȫ�ݳ�������������ˮ��ϴ�����¶������ճ������Һ��C�У�����2��3�μ���ָʾ������0.5000mol��L-1��NaOH�ζ���
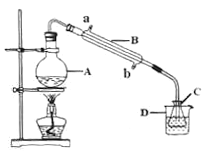
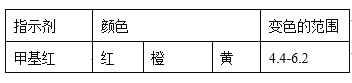
��֪��
�ٵ��ζ����յ�ʱ����������NaOH��Һ___mL(ȷ��0.01mL)��
�ڵ�������ԭ���ⶨij[Co(NH3)x]Cl3������xֵ��ʵ�������δ����������ˮ��ϴ�����¶��������ճ������Һ��C�У���xֵ��______������ƫ��������ƫС��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ѡ���У������������α�ʾΪX��Y��Z��������ͼ������Բ��ʾ�Ĵ�����ϵ��������ǣ�

A. ����������������
B. ������������������������
C. ���塢��ɢϵ�������
D. ���ֽⷴӦ���û���Ӧ����ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���з�Ӧ2H2��O2===2H2O��Ҫ����ȼ�ϵ�أ���ͨ���Ӧ��________������ͨ���Ӧ�� ________���缫��Ӧʽ�ֱ�Ϊ������__________________________��������________________��
(2)���KOH��ΪϡH2SO4�����Һ����缫��Ӧʽ�ֱ�Ϊ������__________��������______��
(3)���H2��Ϊ���飬KOH��Һ�����Һ������ӦʽΪ��______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com