
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,W的单质为常见的半导体材料,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断正确的是( )
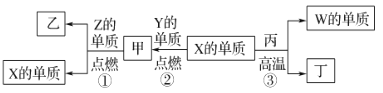
A.X的氢化物沸点低于Y的氢化物沸点
B.W的单质可以用作计算机芯片,太阳能电池,丙是玛瑙的主要成分
C.甲、丙、丁均为酸性化合物
D.工业上用X的单质和乙来制取Z单质
【答案】B
【解析】
X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,可在甲中燃烧生成X的单质,应为镁与二氧化碳的反应,则Z为Mg,甲为CO2,乙为MgO,由此关系可知X为C元素,W的单质为常见的半导体材料,X、W为同一主族元素,则W为Si,Y为O元素,丁为CO,丙为SiO2,以此解答该题。
A. X的氢化物为烃,Y的氢化物为水,烃的种类很多,其沸点不一定低于水,故A错误;
B. W为Si,是良好的半导体材料,可以用作计算机芯片、太阳能电池,丙为二氧化硅,是玛瑙的主要成分,故B正确;
C. 丁为CO,不能与碱反应生成盐和水,所以不是酸性氧化物,故C错误;
D. 工业用电解质熔融的氯化镁的方法冶炼镁,故D错误;
故选B。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用右图装置可验证同主族非金属性的变化规律。设计了如下系列实验。
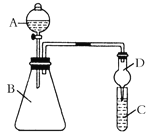
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____________________________________________。
(2)仪器A的名称为____________________,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4, (KMnO4 与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液 的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用______________溶液吸收尾气。
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3,C中加Na2SiO3 溶液观察到C中溶液_____________的现象,即可证明。但有的同学认为盐酸具有挥发性,应用__________溶液除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学取一定量淀粉进行水解实验,其实验步骤如下所示:

请回答下列问题:
① 所加入的试剂分别是
A_______,B________,C________;
② 加B的原因是_____________________________________________________;
③由此可知淀粉是________(填“部分”、“完全”或“没有”)水解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A. 洗气瓶中产生的沉淀是碳酸钡B. 洗气瓶中产生的沉淀是亚硫酸钡
C. 在Z导管出来的气体中没有二氧化碳D. 在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯的结构和性质,下列说法正确的是
A.![]() 的习惯命名是间二甲苯
的习惯命名是间二甲苯
B.苯在空气中不易燃烧完全,燃烧时冒浓烟
C.煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃
D.向2mL苯中加入1mL酸性高锰酸钾溶液,振荡后静置,可观察到液体分层,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-时,S2![]() 转化成( )
转化成( )
A.S2-B.SC.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
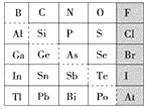
(1)元素Ga在元素周期表中的位置为:第_____周期第____族。
(2)Sn的最高正价为____,Cl的最高价氧化物对应水化物的化学式为___,Bi的最高价氧化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是______元素(填元素符号)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4______H2SeO4(填“>”“<”或“=”)。
③氢化物的还原性:H2O______H2S(填“>”“<”或“=”)。
④原子半径比较:N______Si(填“>”“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找______(填序号)。
A.优良的催化剂 B.半导体材料C.合金材料 D.农药
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
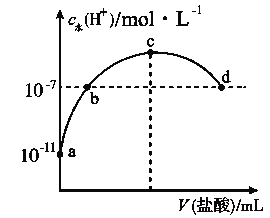
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。
请回答下列问题:
I.乙烷蒸汽裂解技术是工业上应用成熟的乙烯制备方法:C2H6(g)![]() C2H4(g)+H2(g) △H。
C2H4(g)+H2(g) △H。
(1)已知:C2H6(g)、H2(g)和CH2CH2(g)的标准燃烧热分别是1560kJ·mol-1、285.8kJ·mol-1和1411.0kJ·mol-1,则△H=___。
(2)1000℃时,在某刚性密闭容器内充入一定量的C2H6(g),只发生反应C2H6(g)![]() CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
A.升高温度 B.通入惰性气体
C.增加乙烷浓度 D.加入催化剂
II.乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+![]() O2(g)
O2(g)![]() C2H4(g)+H2O(g)△H=-149kJ·mol-1。
C2H4(g)+H2O(g)△H=-149kJ·mol-1。
(3)在乙烷氧化过程中,若![]() 过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中
过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中![]() 的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
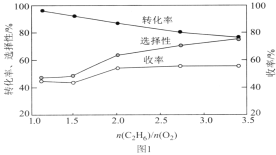
①n![]() 的最佳比值应为__。
的最佳比值应为__。
②![]() 较低时,生成乙烯的选择性较低的原因可能为__。
较低时,生成乙烯的选择性较低的原因可能为__。
Ⅲ.我国科学家利用固体氧化物电解池成功实现了乙烷电化学脱氢制备乙烯,装置如图2所示:
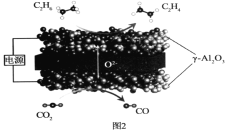
(4)通入CO2的电极为___极(填“阳”或“阴”);C2H6生成C2H4的电极反应式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com