
| A. | 电池放电时,PbO2是电池的正极,被氧化 | |
| B. | 电池放电时,SO42-只在负极发生反应 | |
| C. | 电池充电时,溶液的pH不断增大 | |
| D. | 电池充电时,阳极反应式为PbSO4+2H2O-2e-═PbO2+SO42-+4H+ |
分析 充电时,阳极发生氧化反应,阴极发生还原反应,是放电时的逆反应,阴极电极反应式为PbSO4+2e-=Pb+SO42-,而阳电极反应式为PbSO4+2H2O-2e-═PbO2+SO42-+4H+,由此分析解答.
解答 解:A.放电时,Pb失电子作负极、二氧化铅作正极,正极上得电子发生还原反应被还原,故A错误;
B.放电时,电解质溶液中负极反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),正极反应式为PbO2+2e-+SO42-+4H+=PbSO4+2H2O,所以正负极上硫酸根离子都参加反应,故B错误;
C.充电时,硫酸铅和水反应生成铅、二氧化铅和硫酸,导致氢离子浓度增大,溶液的pH降低,故C错误;
D.充电时,阳极上失电子发生氧化反应,电极反应式为PbSO4+2H2O-2e-═PbO2+SO42-+4H+,故D正确;
故选D.
点评 本题考查常见化学电源电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 氧化铝的熔点很高,所以不可以用来冶炼铝 | |
| B. | 氢氧化铝是一种胶状沉淀,有较大表面积,有吸附性,可用作净水剂 | |
| C. | 实验室可以用氢氧化钠与氯化铝来制备氢氧化铝 | |
| D. | 氢氧化铝既可与强酸反应又可与强碱反应,是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
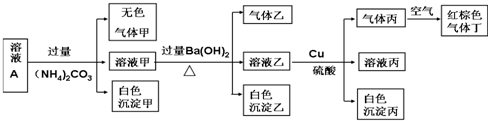
| A. | 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定没有Fe3+,但是无法确定是否含有I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
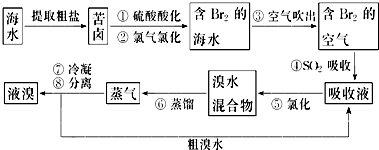
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:2CH3OH+2H2O-12e-═2CO2↑+12H+ | |
| B. | 放电一段时间后,负极的PH值升高 | |
| C. | 放电一段时间,阳离子向负极移动,阴离子向正极移动 | |
| D. | 该电池在工作时,每消耗32gCH3OH,外电路中通过6mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰与水共存物属于混合物 | B. | 冰的密度比水大 | ||
| C. | 冰与二氧化硅的晶体类型相似 | D. | 氢键在冰晶体结构中起关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO2属于酸性氧化物 | |
| B. | CO与O形成化学键的过程中放出能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键的过程中有电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
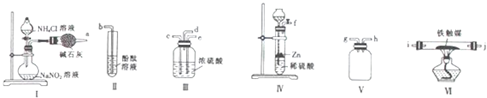
 f,e;d,i,j,g,h,b(填玻璃接口字母)
f,e;d,i,j,g,h,b(填玻璃接口字母)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸溶液:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜与硝酸银溶液:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙加入稀盐酸:CO32-+2H+=H2O+CO2↑ | |
| D. | 氢氧化钠溶液加入稀硫酸:H++OH-=H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com