
”¾ĢāÄæ”æijŹµŃ銔×éÓĆĻĀĮŠ×°ÖĆ½ųŠŠŅŅ“¼“ß»ÆŃõ»ÆµÄŹµŃ锣
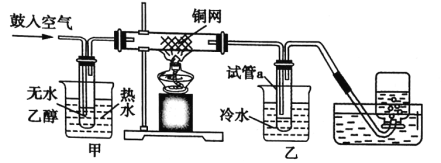
£Ø1£©ŹµŃé¹ż³ĢÖŠĶĶų³öĻÖŗģÉ«ŗĶŗŚÉ«½»ĢęµÄĻÖĻó£¬ĒėŠ“³öŹµŃé¹ż³ĢÖŠ·¢Éś·“Ó¦µÄ×Ü»Æѧ·½³ĢŹ½£ŗ___£»ŌŚ²»¶Ļ¹ÄČėæÕĘųµÄĒéæöĻĀ£¬ĻØĆš¾Ę¾«µĘ£¬·“Ó¦ČŌÄܼĢŠų½ųŠŠ£¬ĖµĆ÷øĆ·“Ó¦ŹĒ__£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
£Ø2£©¼×ŹĒČČĖ®Ō”£¬ŅŅŹĒĄäĖ®Ō”£¬Į½øöĖ®Ō”×÷ÓĆ²»ĻąĶ¬£¬¼×µÄ×÷ÓĆŹĒ___£»ŅŅµÄ×÷ÓĆŹĒ___”£
£Ø3£©·“Ó¦½ųŠŠŅ»¶ĪŹ±¼äŗó£¬ŹŌ¹ÜaÖŠÄÜŹÕ¼Æµ½µÄÓŠ»śĪļÖ÷ŅŖÓŠ___”¢___”£
£Ø4£©ČōŹŌ¹ÜaÖŠŹÕ¼Æµ½µÄŅŗĢåÓĆ×ĻÉ«ŹÆČļŹŌÖ½¼ģŃ飬ŹŌÖ½ĻŌŗģÉ«£¬ĖµĆ÷ŅŗĢåÖŠ»¹ÓŠ__”£ŅŖ³żČ„øĆĪļÖŹ£¬æÉĻČŌŚ»ģŗĻŅŗÖŠ¼ÓČė___£ØĢīŠ“×ÖÄø£©£¬Č»ŗóĶعżÕōĮó¼“æÉ”£
A.ĀČ»ÆÄĘČÜŅŗ B.±½ C.Ģ¼ĖįĒāÄĘČÜŅŗ D.ĖÄĀČ»ÆĢ¼
”¾“š°ø”æ2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O ·ÅČČ Ź¹ŅŅ“¼Ęū»Æ³ÉŅŅ“¼ÕōĘų ĄäČ“²śÉśµÄŅŅČ©µČĘųĢå ŅŅČ© ŅŅ“¼ ŅŅĖį C
2CH3CH2CHO+2H2O ·ÅČČ Ź¹ŅŅ“¼Ęū»Æ³ÉŅŅ“¼ÕōĘų ĄäČ“²śÉśµÄŅŅČ©µČĘųĢå ŅŅČ© ŅŅ“¼ ŅŅĖį C
”¾½āĪö”æ
¼×ÖŠ¹ÄČėæÕĘų£¬ĒŅŌŚĖ®Ō”¼ÓČČĢõ¼žĻĀ£¬ŃõĘųŗĶŅŅ“¼ŌŚĶ“ß»ÆĻĀ£¬¼ÓČČ·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉŅŅČ©ŗĶĖ®£¬½ųČėŅŅÖŠµÄŅŅ“¼”¢ŅŅČ©£¬ŌŚĄäČ“ĻĀæÉŹÕ¼Æµ½ŅŅČ©£¬¼ÆĘųĘæŹÕ¼ÆµÄĪŖµŖĘų£¬¾Ż“Ė½ā“š”£
£Ø1£©ĶÓėŃõĘų·“Ӧɜ³ÉŗŚÉ«µÄŃõ»ÆĶ£¬Ńõ»ÆĶÓėŅŅ“¼·¢Éś·“Ӧɜ³ÉĶ”¢ŅŅČ©ŗĶĖ®£¬øĆ¹ż³ĢµÄ×Ü»Æѧ·½³ĢŹ½ĪŖ2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O£»ĻØĆš¾Ę¾«µĘ£¬·“Ó¦ČŌÄܼĢŠų½ųŠŠ£¬ĖµĆ÷øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬·Å³öµÄČČĮæ×ćŅŌĪ¬³Ö·“Ó¦½ųŠŠ”£
2CH3CH2CHO+2H2O£»ĻØĆš¾Ę¾«µĘ£¬·“Ó¦ČŌÄܼĢŠų½ųŠŠ£¬ĖµĆ÷øĆ·“Ó¦ŹĒ·ÅČČ·“Ó¦£¬·Å³öµÄČČĮæ×ćŅŌĪ¬³Ö·“Ó¦½ųŠŠ”£
“š°øĪŖ£ŗ2CH3CH2CH2OH+O2![]() 2CH3CH2CHO+2H2O£»·ÅČČ·“Ó¦”£
2CH3CH2CHO+2H2O£»·ÅČČ·“Ó¦”£
£Ø2£©¼×ŗĶŅŅĮ½øöĖ®Ō”×÷ÓĆ²»Ķ¬£¬¼×ŹĒČČĖ®Ō”£¬×÷ÓĆŹĒŹ¹ŅŅ“¼Ę½ĪČĘū»Æ³ÉŅŅ“¼ÕōĘų£¬ŅŅŹĒĄäĖ®Ō”£¬×÷ÓĆŹĒ½«ŅŅČ©ĄäČ“ĻĀĄ“”£
“š°øĪŖ£ŗŹ¹ŅŅ“¼Ęū»Æ³ÉŅŅ“¼ÕōĘų£»ĄäČ“²śÉśµÄŅŅČ©µČĘųĢ唣
£Ø3£©ŅŅ“¼±»Ńõ»ÆĪŖŅŅČ©£¬Ķ¬Ź±Éś³ÉĖ®£¬ŅŅ“¼²»ÄÜĶźČ«·“Ó¦£¬aÖŠĄäČ“ŹÕ¼ÆµÄÓŠ»śĪļÓŠ£ŗŅŅČ©”¢ŅŅ“¼”£
“š°øĪŖ£ŗŅŅČ©”¢ŅŅ“¼”£
£Ø4£©ČōŹŌ¹ÜaÖŠŹÕ¼Æµ½µÄŅŗĢåÓĆĄ¶É«ŹÆČļŹŌÖ½¼ģŃ飬ŹŌÖ½ĻŌŗģÉ«£¬ĖµĆ÷ČÜŅŗ³ŹĖįŠŌ£¬ŌņČÜŅŗÖŠŗ¬ÓŠŅŅĖį£»ŅŅĖį¾ßÓŠĖįµÄĶØŠŌ£¬4øöŃ”ĻīÖŠ£¬Ö»ÓŠĢ¼ĖįĒāÄĘæÉŅŌŗĶŅŅĖį·“Ó¦£¬Éś³ÉŅŅĖįÄĘ”¢Ė®ŗĶ¶žŃõ»ÆĢ¼£¬Č»ŗóŌŁĶعżÕōĮó¼“æÉ”£
“š°øĪŖ£ŗŅŅĖį£»C ”£


 ¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø
¼ā×ÓÉśŠĀæĪĢĆæĪŹ±×÷ŅµĻµĮŠ“š°ø Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
Ó¢²Å¼Ę»®Ķ¬²½æĪŹ±øߊ§ŃµĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ·ØŅ½³£ÓĆĀķŹĻŹŌÉé·Ø¼ģŃéŹĒ·ńÅųĖŖ( As2O3)ÖŠ¶¾£¬Éę¼°µÄ·“Ó¦ČēĻĀ£ŗ
I£ŗ6Zn+As2O3+12HCl=6ZnCl2+2AsH3£ØÉéĶ飩”ü+3H2O
¢ņ£ŗ2AsH3=2As£ØŗŚÉ«Éé¾µ£©+3H2
£Ø1£©Š“³öÉéµÄ»łĢ¬Ō×Ó¼Ūµē×ÓÅŲ¼Ķ¼______________”£
£Ø2£©ÉéĶéµÄæÕ¼ä½į¹¹ĪŖ_______£»ÉéĶéÖŠŠÄŌ×ÓŌӻƷ½Ź½ĪŖ________”£
£Ø3£©ÉéĶéĶ¬×åĶ¬ĻµĮŠĪļÖŹĻą¹ŲŠŌÖŹČēĻĀ±ķ£ŗ
NH3 | PH3 | AsH3 | SbH3 | |
ČŪµć/”ę | -77.8 | -133.5 | -116.3 | -88 |
·Šµć/”ę | -34.5 | -87.5 | -62.4 | -18.4 |
“ÓPH3”śAsH3”śSbH3ČŪ·ŠµćŅĄ“ĪÉżøßµÄŌŅņŹĒ_________£»NH3·Ö×ÓĄżĶāµÄŌŅņŹĒ_______”£
£Ø4£©µŚŅ»µēĄėÄÜŹż¾ŻI(As)>I(Se)£¬æÉÄܵÄŌŅņŹĒ_____________”£
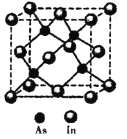
£Ø5£©ÉéÓėī÷(In)ŠĪ³ÉµÄ»ÆŗĻĪļ(X)¾ßÓŠÓÅĮ¼µÄ¹āµēŠŌÄÜ£¬¹ć·ŗÓ¦ÓĆÓŚ¹āĻĖĶØŠÅÓĆ¼¤¹āĘ÷£¬Ę侧°ū½į¹¹ČēĶ¼ĖłŹ¾£¬ŌņĘä»ÆѧŹ½ĪŖ______£»¾§°ū±ß³¤a= 666.67pm£¬ŌņĘäĆܶČĪŖ_____g/cm3£Ø±ß³¤aæÉÓĆ![]() ½üĖĘ¼ĘĖć£¬ÉčNA=6.0”Į1023/mol£©”£
½üĖĘ¼ĘĖć£¬ÉčNA=6.0”Į1023/mol£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫1.00molL-1NaOHČÜŅŗµĪČė20.00mL1.00molL-1µÄŅ»ŌŖĖįHAČÜŅŗÖŠ£¬²āµĆ»ģŗĻČÜŅŗµÄpHŗĶĪĀ¶ČĖę¼ÓČėNaOHČÜŅŗĢå»ż±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
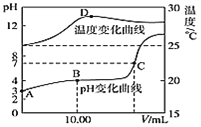
(1)¼ĘĖćŹŅĪĀŹ±20.00mL1.00molL-1µÄŅ»ŌŖĖįHAµÄµēĄė¶Č¦Į=________
(2)Ķ¼ÖŠBµćĖłŹ¾µÄČÜŅŗÖŠĖłŗ¬ø÷Ąė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ_________
(3)ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ_______(ĢīĻąÓ¦ŠņŗÅ).
A.ÓÉĶ¼ÖŠæÉÖŖNaOHŗĶHA·“Ó¦µÄ![]() H£¾0
H£¾0
B.Ķ¼ÖŠCµćĖł¼ÓNaOHČÜŅŗµÄĢå»żV=20.00mL
C.Ķ¼ÖŠCµćŹ±ČÜŅŗµÄKWĀŌ“óÓŚ1”Į10-14molL-1£¬ČÜŅŗÖŠc(H+)=1”Į10-7molL-1
D.Ķ¼ÖŠDµćŗó£¬ČÜŅŗĪĀ¶ČĀŌĻĀ½µµÄÖ÷ŅŖŌŅņŹĒÉś³ÉµÄNaAĖ®½āĪüČČ
(4)³£ĪĀĻĀŌŚ20mL0.1molL-1Na2CO3ČÜŅŗÖŠÖšµĪ¼ÓČė0.1molL-1HClČÜŅŗ40mL£¬ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄø÷ÖÖĪ¢Į£(CO2ŅņŅŻ³öĪ“»³ö)ĪļÖŹµÄĮæ·ÖŹż(ׯÖį)ĖęČÜŅŗpH±ä»ÆµÄ²æ·ÖĒéæöČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
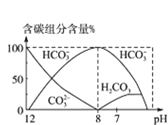
¢ŁŌŚĶ¬Ņ»ČÜŅŗÖŠ£¬H2CO3”¢HCO3-”¢CO32-_________(Ģī”°ÄÜ”±»ņ”°²»ÄÜ”±)“óĮæ¹²“ę£»
¢Śµ±pH=7Ź±£¬ČÜŅŗÖŠŗ¬Ģ¼ŌŖĖŲµÄÖ÷ŅŖĪ¢Į£ĪŖ_______£¬ČÜŅŗÖŠø÷ÖÖĄė×ÓµÄĪļÖŹµÄĮæÅØ¶ČµÄ“óŠ”¹ŲĻµĪŖ______________£»
¢ŪŅŃÖŖŌŚ25”ꏱ£¬CO32-Ė®½ā·“Ó¦µÄĘ½ŗā³£Źż¼“Ė®½ā³£ŹżKh=2”Į10-4molL-1£¬µ±ČÜŅŗÖŠc(HCO3-)£ŗc(CO32-)=2£ŗ1Ź±£¬ČÜŅŗµÄpH=____
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČĖĢåŃŖŅŗÖŠ“ęŌŚµÄĘ½ŗā£ŗH2CO3 ![]() HCO3-£¬Ź¹ŃŖŅŗpH±£³ÖŌŚ7.35 ~ 7.45Ö®¼ä£¬·ńŌņ¾Ķ»į·¢ÉśĖįÖŠ¶¾»ņ¼īÖŠ¶¾”£ŅŃÖŖpHĖę
HCO3-£¬Ź¹ŃŖŅŗpH±£³ÖŌŚ7.35 ~ 7.45Ö®¼ä£¬·ńŌņ¾Ķ»į·¢ÉśĖįÖŠ¶¾»ņ¼īÖŠ¶¾”£ŅŃÖŖpHĖę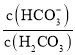 ±ä»Æ¹ŲĻµČē±ķĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ
±ä»Æ¹ŲĻµČē±ķĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÖŠ“ķĪóµÄŹĒ
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7µÄŃŖŅŗÖŠ£¬c(HCO3-)>c(H2CO3)
B.Õż³£ĢåĪĀĻĀČĖĢå·¢Éś¼īÖŠ¶¾Ź±£¬c(H+)c(OH-)±ä“ó
C.ČĖĢå·¢ÉśĖįÖŠ¶¾Ź±£¬æɾ²ĀöµĪ×¢Ņ»¶ØÅØ¶ČµÄNaHCO3ČÜŅŗ½ā¶¾
D.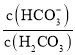 £½20.0Ź±£¬H2CO3µÄµēĄė³Ģ¶ČŠ”ÓŚHCO3-µÄĖ®½ā³Ģ¶Č
£½20.0Ź±£¬H2CO3µÄµēĄė³Ģ¶ČŠ”ÓŚHCO3-µÄĖ®½ā³Ģ¶Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ
ČĖĄąĪÄĆ÷µÄ·¢Õ¹Ąś³Ģ£¬Ņ²ŹĒ»ÆѧĪļÖŹµÄČĻŹ¶ŗĶ·¢Ļֵĥś³Ģ£¬ĘäÖŠĢś”¢¶žŃõ»ÆĢ¼”¢ĒąĆ¹ĖŲ”¢ĻõĖį¼Ų”¢ŅŅ“¼”¢°±µČ”°·Ö×Ó”±øÄ±ä¹żČĖĄąµÄŹĄ½ē”£
£Ø1£©ĢśŌ×ÓŌŚ»łĢ¬Ź±£¬ĶāĪ§µē×ÓÅŲ¼Ź½ĪŖ____________”£
£Ø2£©CO2µÄµē×ÓŹ½ĪŖ____________£¬1 mol CO2·Ö×ÓÖŠŗ¬ÓŠ¦Ņ¼üµÄĪļÖŹµÄĮæĪŖ____________”£
£Ø3£©6-°±»łĒąĆ¹ĶéĖįµÄ½į¹¹ČēĶ¼ĖłŹ¾£ŗ
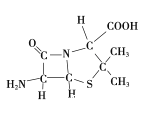
¢ŁĘäÖŠC”¢N”¢OŌ×Ó°ė¾¶µÄ“󊔹ŲĻµĪŖ____________£¬µēøŗŠŌµÄ“󊔹ŲĻµĪŖ____________£»
¢ŚĘäÖŠ²ÉÓĆsp3ŌӻƵÄŌ×ÓÓŠC”¢____________”£
£Ø4£©ĻõĖį¼ŲÖŠNO3-µÄæռ乹ŠĶĪŖ____________£¬Š“³öÓėNO3-»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖÓÉĒ°¶žÖÜĘŚŌŖĖŲŌ×Ó¹¹³ÉµÄ·Ē¼«ŠŌ·Ö×Ó»ÆѧŹ½____________”£
£Ø5£©ŅŅ“¼µÄĻą¶Ō·Ö×ÓÖŹĮæ±ČĀČŅŅĶ銔£¬µ«Ęä·Šµć±ČĀČŅŅĶéøߣ¬ĘäŌŅņŹĒ____________”£
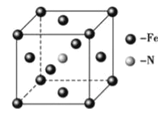
£Ø6£©ĢśŗĶ°±ĘųŌŚ640”ęæÉ·¢ÉśÖĆ»»·“Ó¦£¬²śĪļÖ®Ņ»µÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£¬ČōĮ½øö×ī½üµÄFeŌ×Ó¼äµÄ¾ąĄėĪŖa cm£¬ŌņøĆ¾§ĢåµÄĆÜ¶Č¼ĘĖćŹ½ĪŖ____________g/cm3£ØÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£Źż£©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”涞“Īµē³Ųļ®Ąė×Óµē³Ų¹ć·ŗÓ¦ÓĆÓŚŹÖ»śŗĶµēÄŌµČµē×Ó²śĘ·ÖŠ”£Ä³³£¼ūļ®Ąė×Óµē³Ų·ÅµēŹ±µē³ŲµÄ×Ü·“Ó¦ĪŖ£ŗLi1-xCoO2+LixC6=LiCoO2+ C6(x<1)”£2018ÄźÖŠ¹ś»ŲŹÕĮĖČ«ĒņæÉ»ŲŹÕļ®Ąė×Óµē³Ų×ÜĮæµÄ69%”£µ«Ļֽ׶ĪĪŅ¹ś·Ļ¾Éµē³Ų»ŲŹÕČŌŹōÓŚĄĶ¶ÆĆܼƊĶ²śŅµ£¬Š§ĀŹČŌŠčĢįøß”£Ņ»ÖÖ»ŲŹÕøĆļ®Ąė×Óµē³ŲÖŠµÄļ®ŗĶīܵÄĮ÷³Ģ£ŗ
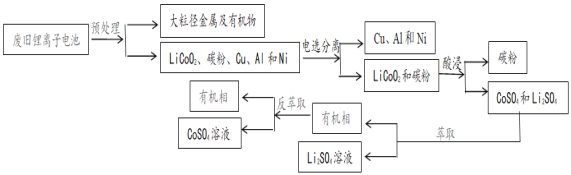
ŅŃÖŖ£ŗ¢Ł Na2S2O3ŹĒŅ»ÖÖÖŠµČĒæ¶ČµÄ»¹Ō¼Į£¬ÓöĒæĖį·Ö½ā
¢Ś Li2CO3Čܽā¶ČĖęĪĀ¶ČÉżø߶ų¼õŠ”
£Ø1£©¹ŲÓŚøĆļ®Ąė×Óµē³ŲĖµ·Ø²»ÕżČ·µÄŹĒ_______________________________
A£®ļ®Ąė×Óµē³ŲÖŠĪŽ½šŹōļ®£¬³ä·Åµē¹ż³ĢÖŠ£¬Li+ŌŚĮ½øöµē¼«Ö®¼äĶł·µĒ¶ČėŗĶĶŃĒ¶
B£®¼ÆÖŠŌ¤“¦ĄķŹ±£¬ĪŖ·ĄÖ¹¶ĢŹ±¼äÄŚæģĖŁ·ÅµēŅżĘšČ¼ÉÕÉõÖĮ±¬ÕØ£¬Ó¦ĻČ½ųŠŠ·Åµē“¦Ąķ
C£®³äµēŹ±Čō×ŖŅĘ0.01molµē×Ó£¬ŹÆÄ«µē¼«½«¼õÖŲ0.07g
D£®³äµēŹ±£¬Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖLiCoO2£xe£===Li1£xCoO2£«xLi£«
£Ø2£©LiCoO2ŹĒŅ»ÖÖ¾ßÓŠĒæŃõ»ÆŠŌµÄÄŃČÜø“ŗĻ½šŹōŃõ»ÆĪļ£¬ĒŅCo3+ŌŚ³£ĪĀ”¢pH=0.5Ģõ¼žĻĀ¼“æŖŹ¼Ė®½ā”£LiCoO2æÉČÜÓŚĮņĖįµĆCoSO4”£ÓĆĮņĖįĖį½žŹ±£¬ŠčŅŖ¼ÓČėNa2S2O3×÷ÖśČܼĮ£¬“Ó»Æѧ·“Ó¦ŌĄķµÄ½Ē¶Č½āŹĶŌŅņ£ŗ_______________________________£¬Š“³ö½ž³öCoSO4µÄĄė×Ó·“Ó¦·½³ĢŹ½£ŗ__________________
£Ø3£©æŲÖĘĒāĄė×ÓÅضČĪŖ4mol/L£¬·“Ó¦ĪĀ¶Č90”ę£¬²āµĆĻąĶ¬Ź±¼äÄŚĄė×ӵĽž³öĀŹÓėNa2S2O3ČÜŅŗµÄ±ä»Æ¹ŲĻµČēĶ¼”£ŌņĖį½žŹ±Ó¦Ń”ÓĆÅضČĪŖ_______mol/LµÄNa2S2O3ČÜŅŗ”£Na2S2O3ČÜŅŗÅضČŌöÖĮ0.3mol/LŹ±£¬LiCoO2µÄ½ž³öĀŹĆ÷ĻŌĻĀ½µ£¬æÉÄܵÄŌŅņŹĒ_________________£ØÓĆ»Æѧ·½³ĢŹ½½įŗĻĪÄ×ÖĖµĆ÷£©
£Ø4£©Õūøö»ŲŹÕ¹¤ŅÕÖŠ£¬æÉŃ»·Ź¹ÓƵÄĪļÖŹŹĒ_____________________
£Ø5£©ŅŃÖŖ15”ę×óÓŅLi2CO3µÄKspĪŖ3.210£2£¬øĆĪĀ¶ČĻĀLi2CO3µÄČܽā¶ČŌ¼ĪŖ_____g”£½«ŻĶČ”ŗóµÄLi2SO4ČÜŅŗ¼ÓČČÖĮ95”ę£¬¼ÓČė±„ŗĶNa2CO3ČÜŅŗ£¬·“Ó¦10min£¬________________£ØĢī²Ł×÷£©µĆLi2CO3·ŪÄ©”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĮ«»ØĒåĪĮ½ŗÄŅ¶ŌŠĀ¹Ś·ĪŃ×Ēį֢ד»¼ÕßÓŠĻŌÖųĮĘŠ§£¬ĘäÓŠŠ§³É·ÖĀĢŌĖį“ęŌŚČēĶ¼×Ŗ»Æ¹ŲĻµ£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
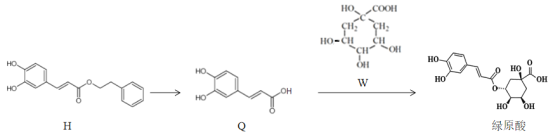
A.HµÄ·Ö×ÓŹ½ĪŖC17H14O4
B.QÖŠĖłÓŠĢ¼Ō×Ó²»æÉÄܶ¼¹²Ćę
C.1molĀĢŌĖįÓė×ćĮæNaHCO3ČÜŅŗ·“Ó¦£¬×ī¶ą·Å³ö1molCO2
D.H”¢Q”¢W¾łÄÜ·¢ÉśŃõ»Æ·“Ó¦”¢Č”“ś·“Ó¦”¢ĻŌÉ«·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹµŃéŹŅÓĆÉŁĮæµÄäåŗĶ×ćĮæµÄŅŅ“¼Öʱø1£¬2Ņ»¶žäåŅŅĶéµÄ×°ÖĆČēĶ¼ĖłŹ¾£ŗ

ÓŠ¹ŲŹż¾ŻĮŠ±ķČēĻĀ£ŗ
ŅŅ“¼ | 1.2¶žäåŅŅĶé | ŅŅĆŃ | |
דĢ¬ | ĪŽÉ«ŅŗĢå | ĪŽÉ«ŅŗĢå | ĪŽÉ«ŅŗĢå |
ĆܶČ/g/cm©3 | 0.79 | 2.2 | 0.71 |
·Šµć/”ę | 78.5 | 132 | 34.6 |
ČŪµć/”ę | ©130 | 9 | ©116 |
Ēė°“ŅŖĒó»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öA×°ÖĆÖŠµÄ»Æѧ·“Ó¦·½³ĢŹ½_____£»
£Ø2£©×°ÖĆCÖŠŹ¢ÓŠĒāŃõ»ÆÄĘČÜŅŗ£¬Ęä×÷ÓĆŹĒ_____
£Ø3£©ŌŚ“ĖÖʱøŹµŃéÖŠ£¬ŅŖ¾”æÉÄÜŃøĖŁµŲ°Ń·“Ó¦ĪĀ¶ČĢįøßµ½170”ę×óÓŅ£¬Ęä×īÖ÷ŅŖÄæµÄŹĒ_____
£Ø4£©ÅŠ¶ĻøĆÖʱø·“Ó¦ŅŃ¾½įŹųµÄ×ī¼ņµ„·½·ØŹĒ_____£»
£Ø5£©Čō²śĪļÖŠÓŠÉŁĮæĪ“·“Ó¦µÄBr2£¬×īŗĆÓĆ_____Ļ“µÓ³żČ„£»£ØĢīÕżČ·Ń”ĻīĒ°µÄ×ÖÄø£©
a Ė® b ŃĒĮņĖįĒāÄĘ c µā»ÆÄĘČÜŅŗ d ŅŅ“¼
£Ø6£©·“Ó¦¹ż³ĢÖŠÓ¦ÓĆĄäĖ®ĄäȓװÖĆD£¬ĘäÖ÷ŅŖÄæµÄŹĒ_____£»µ«ÓÖ²»Äܹż¶ČĄäČ“£ØČēÓƱłĖ®£©£¬ĘäŌŅņŹĒ_____£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżÖµ£¬ĻĀĮŠŠšŹöÖŠÕżČ·µÄ
A.0.4 mol NH3Óė0.6 mol O2ŌŚ“߻ƼĮµÄ×÷ÓĆĻĀ³ä·Ö·“Ó¦£¬µĆµ½NOµÄ·Ö×ÓŹżĪŖ0.4NA
B.C60ŗĶŹÆÄ«µÄ»ģŗĻĪļ¹²1.8 g£¬ŗ¬Ģ¼Ō×ÓŹżÄæĪŖ0.15NA
C.1 L 0.1 mol/LNH4Al(SO4)2ČÜŅŗÖŠŃōĄė×Ó×ÜŹżŠ”ÓŚ0.2NA
D.5.6 gĢśŌŚ×ćĮæµÄO2ÖŠČ¼ÉÕ£¬×ŖŅʵĵē×ÓŹżĪŖ0.3NA
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com