
| A. | 标准状况下,22.4LH2O所含原子个数大于3NA | |
| B. | 100ml18.4mol/L硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 100g质量分数为34.2%的蔗糖分子水溶液中含H原子数为2.2NA |
分析 A、标况下水为液体;
B、铜只能和浓硫酸反应,和稀硫酸不反应;
C、在MgCO3的饱和溶液中,c(Mg2+)=c(CO32-);
D、在蔗糖溶液中,除了蔗糖分子外,水也含H原子.
解答 解:A、标况下水为液体,且密度为1g/mL,故22.4L水的质量为22400g,则物质的量大于3mol,故分子个数大于3NA个,故A正确;
B、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则生成的二氧化硫分子小于0.92NA个,故B错误;
C、在MgCO3的饱和溶液中,c(Mg2+)=c(CO32-),根据Ksp=4×10-6可知,饱和溶液中镁离子的浓度为2×10-3mol/L,但由于溶液体积未知,故镁离子的个数无法计算,故C错误;
D、在蔗糖溶液中,除了蔗糖分子外,水也含H原子,故溶液中H原子的个数多于2.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32- | B. | OH- | C. | SO42- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 800℃ | a | b | 83% |
| 900℃ | c | 75% | d |
| 1000℃ | 54% | e | f |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合金中铁、锌的物质的量之和为0.02mol | |
| B. | 合金中铜的质量无法确定 | |
| C. | 合金中铁、铜的物质的量之和为0.01mol | |
| D. | 1.30g>铁和锌质量之和>1.12g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 维生素C具有还原性,在人体内起抗氧化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
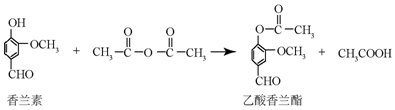
| A. | 乙酸香兰酯的分子式为C18H8O4 | |
| B. | FeCl3溶液可用于区别香兰素与乙酸香兰酯 | |
| C. | 1mol乙酸香兰酯最多可以与5molH2发生加成反应 | |
| D. | 乙酸香兰脂在足量NaOH溶液中水解得到乙酸和香兰素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com