
| A、中和反应 |
| B、金属与酸反应置换出H2 |
| C、燃烧反应 |
| D、炽热的炭与水蒸气反应制取水煤气 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.612 | 21.20 |
| 2 | 0.612 | 20.10 |
| 3 | 0.612 | 19.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解池是电能转化为化学能的装置 |
| B、原电池跟电解池连接后,电子从原电池负极流向电解池阳极 |
| C、电镀时,电镀池里的阳极材料发生氧化反应 |
| D、用惰性电极电解饱和食盐水时,阴极得到氢氧化钠溶液和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
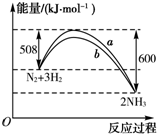
| A、该反应的热化学方程式为N2+3H2?2NH3△H=-92 kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热改变 |
| D、升高温度,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Mg十O2=2MgO |
| B、C十H2O=CO十H2 |
| C、HCl十NaOH=NaCl十H2O |
| D、CaO十H2O=Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在离子化合物里,只存在离子键,没有共价键 |
| B、任何分子中一定都存在化学键 |
| C、在共价化合物分子内,一定不存在离子键 |
| D、全部由非金属元素形成的化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、D一定是金属元素,其金属性比C强 |
| B、C的最高价氧化物对应的水化物一定显强酸性 |
| C、B的氢化物一定是分子晶体,晶体中一定存在氢键 |
| D、E的原子序数一定是A的5倍,且原子半径比A大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)═2H2O(l)△H═-572kJ?mol-1 |
| B、KOH(aq)+CH3COOH (aq)=CH3COOK (aq)+H2O(l);△H=-57.3 kJ?mol-1 |
| C、C8H18(l)+12.5O2 (g)=8CO2(g)+9H2O(l);△H=-5518 kJ?mol-1 |
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H═-533kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com