
| A. | CuO中混有Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有CuCl2:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| D. | 乙烷中混有乙烯:将混合气体通过盛溴水的洗气瓶 |
分析 A.氧化铝与NaOH反应,CuO不能;
B.Fe与氯化铜反应生成氯化亚铁;
C.加入过量NaOH溶液,引入新杂质NaOH;
D.乙烯与溴反应,而乙烷不能.
解答 解:A.氧化铝与NaOH反应,CuO不能,则充分反应后过滤可分离,故A正确;
B.Fe与氯化铜反应生成氯化亚铁,则加入过量铁粉充分反应后过滤可除杂,故B正确;
C.加入过量NaOH溶液,引入新杂质NaOH,不能除杂,应选加热法,故C错误;
D.乙烯与溴反应,而乙烷不能,则选择溴水、洗气可除去杂质,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | MgCO3可以除去MgCl2酸性溶液中的Fe3+ | |
| B. | 实验测得NaHSO3溶液的pH<7,说明则H2SO3是强酸 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 2.24LNO与1.12O2充分反应所得气体中原子数目一定为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
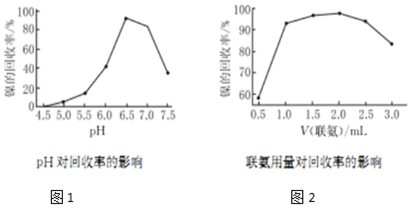
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
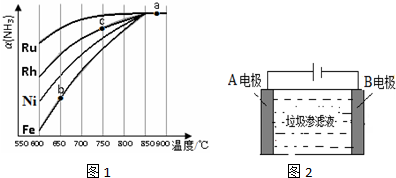
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L NaCl溶液 | B. | 75mL 3mol/L NH4Cl溶液 | ||
| C. | 150mL 2mol/L KCl溶液 | D. | 75mL 2mol/L CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子是化学变化中最小的粒子 | |
| B. | 一切原子的原子核都是由质子、中子构成的 | |
| C. | 分子的质量总比原子质量大 | |
| D. | 分子、原子、离子都能直接构成物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用工业酒精配制饮用酒和调味用的料酒 | |
| B. | 食用白糖的主要成分是蔗糖 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 液化石油气的主要成分是甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com