
【题目】某化学反应2A ![]() B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
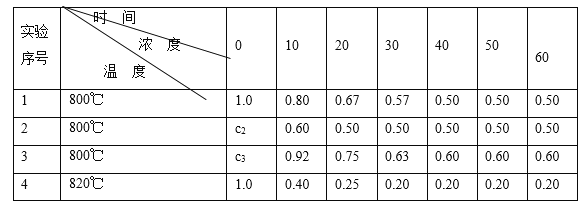
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为_____mol/(L·min)。
(2)在实验2,A的初始浓度c2=____________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是___________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3_______v1(填>、=、<),且c3_______1.0 mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是____反应(选填吸热、放热)。理由是 __________
【答案】0.013 1.0 催化剂 > > 吸热 温度升高时,平衡向右移动
【解析】
(1)根据v=![]() 公式解题;
公式解题;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验2使用了催化剂,加快了反应速率,缩短了达平衡的时间;
(3)以10至20min为例求出实验1和实验3的反应速率进行比较;
(4)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动。
(1)在实验1中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.013 mol/(L·min),故答案为:0.013;
=0.013 mol/(L·min),故答案为:0.013;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验1与实验2中A的初始浓度应相等,起始浓度c2=1.0mol/L,实验2较其他实验达到平衡时间最短,是使用了合适的催化剂,
故答案为:1.0;催化剂;
(3)在实验1中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.013 mol/(L·min),在实验3中,反应在10至20min时间内平均速率为v=
=0.013 mol/(L·min),在实验3中,反应在10至20min时间内平均速率为v=![]() =
=![]() =0.015 mol/(L·min),故v3>v1,实验1的起始浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,即c3>1.0 mol/L,故答案为:>;>;
=0.015 mol/(L·min),故v3>v1,实验1的起始浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,即c3>1.0 mol/L,故答案为:>;>;
(4)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;温度升高时,平衡向右移动。


科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
C(g)+2D(g)在不同条件下的反应速率如下,其中反应速率最快的是( )
A.v(A)=0.2mol/(Ls)B.v(B)=0.6mol/(Ls)
C.v(C)=0.3mol/(Ls)D.v(D)=0.5mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用元素分析仪分析6.4mg某有机化合物,测得生成8.8mgCO2和7.2mgH2O,无其他物质生成。下列说法中,正确的是 ( )
A. 该化合物的分子式为C2H8O2B. 该化合物中碳、氢原子个数比为1:6
C. 无法确定该化合物中是否含有氧元素D. 该化合物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足如图物质一步转化关系的选项是( )
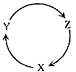
选项 | X | Y | Z |
A | Na | NaOH | NaHCO3 |
B | S | SO2 | SO3 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图1所示,A中放有浓硫酸,B中放有无水乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl26C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |

请回答:
(1)浓硫酸的作用是__________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:__________。
(2)球形干燥管C的作用是__________。若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________。
(3)采用分液法从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出__________;再加入无水硫酸钠除去水,然后进行__________(填操作名称),以得较纯净的乙酸乙酯。
(4)上述实验中饱和碳酸钠溶液的作用是______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
D.加速酯的生成,提高其产率
(5)另一化学课外小组对上述实验进行了改进,设计了图2所示的装置,利用浓硫酸、乙醇、乙酸制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)与图1所示装置相比,此装置的主要优点有(写出一条即可)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备
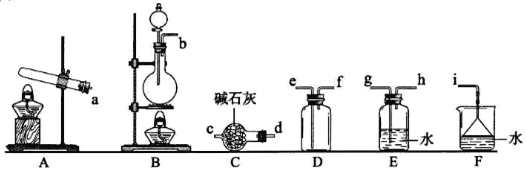
①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
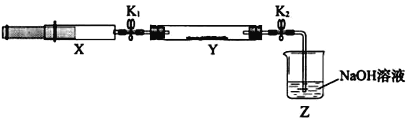
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列离子晶体立体结构示意图:

若以M代表阳离子,以R代表阴离子,则各离子晶体的组成表达式完全正确的组合是( )
A. ①MR ②MR2 ③MR3 ④MR4B. ①MR2 ②MR2 ③MR2 ④MR
C. ①MR ②MR2 ③MR2 ④MRD. ①MR ②MR ③MR2 ④MR2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
①写出实验室制取氨气的化学方程式:______________。
②收集氨气应使用_________法,要得到干燥的氨气可选用_________做干燥剂。
③用如图一装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是___________,该实验的原理是____________________。
④如果只提供如图二的装置,请说明引发喷泉的方法__________________________。
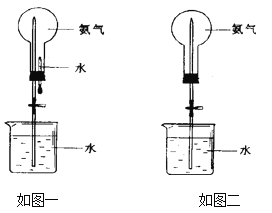
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | I | II | III | IV | V | VI | VII |
一 | ① | ||||||
二 | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________。
(2)④和⑧在周期表中的位置分别是________________;________________。
(3)②和③气态氢化物稳定性的大小顺序:________________(填化学式)。
(4)③⑧⑩的最高价含氧酸的酸性最强的是________________(填化学式)。
(5)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是__(填化学式),属于___(填“共价化合物”或“离子化合物”)。
(6)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为_____。
(7)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是_____(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com