

| A. | 镁片为负极,镁片上产生黄绿色气体 | |
| B. | 铁片为阳极,铁片上产生无色气体 | |
| C. | 溶液中铁片与镁片之间产生白色沉淀 | |
| D. | 溶液的pH将逐渐增大 |
分析 该装置是原电池,镁片作负极,铁片作正极,负极上镁失电子发生氧化反应生成镁离子,正极上氧气得电子发生还原反应生成氢氧根离子,镁离子和氢氧根离子反应生成难溶性的氢氧化镁.
解答 解:该装置是原电池,镁片作负极,铁片作正极,
A.镁片为负极,负极上镁失电子发生氧化反应生成镁离子,故A错误;
B.铁片作正极,正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为:2H2O+O2+4e-=4OH-,故B错误;
C.负极上的电极反应式为:2Mg-4e-=2Mg 2+,正极上的电极反应式为:2H2O+O2+4e-=4 OH-,镁离子和氢氧根离子反应生成难溶性的氢氧化镁,故C正确;
D.由负极上的电极反应式为:2Mg-4e-=2Mg 2+,正极上的电极反应式为:2H2O+O2+4e-=4 OH-,所以总反应为2Mg+2H2O+O2=2Mg(OH)2↓,所以溶液的pH基本不变,故D错误;
故选C.
点评 本题考查原电池原理,明确正负极上发生的反应是解本题的关键,易错选项是D,根据总反应确定溶液的pH,为易错点.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中MnO2是氧化剂 | |
| B. | 该反应属于复分解反应 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: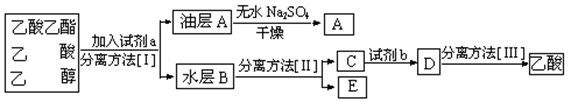
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
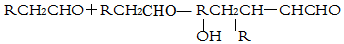 产物不稳定,受热即脱水而生成不饱和醛.
产物不稳定,受热即脱水而生成不饱和醛.
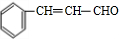 ;F
;F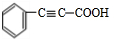 .
.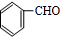 +CH3CHO$\stackrel{△}{→}$
+CH3CHO$\stackrel{△}{→}$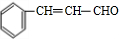 +H2OE→F
+H2OE→F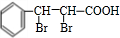 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$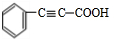 +2NaBr+2H2O
+2NaBr+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com