
下列有关电解质溶液的说法正确的是
A.在蒸馏水中滴加浓H2SO4,KW不变
B.CaCO3难溶于稀硫酸,也难溶于醋酸
C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-)
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
科目:高中化学 来源:2014-2015学年浙江省建人高复高三上学期第三次月考化学试卷(解析版) 题型:填空题
(15分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生如下反应:
CO2 (g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
①此温度下该反应的平衡常数K=__________
②已知: 《1》CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= 890.3 kJ·mol-1
890.3 kJ·mol-1
《2》CO(g)+H2O (g)=CO2(g)+H2 (g) △H=+2.8 kJ·mol-1
《3》2CO(g)+O2(g)=2CO2(g) △H= 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g) 的△H=________________
2CO(g)+2H2(g) 的△H=________________
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如右图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
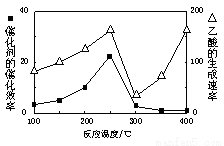
②为了提高该反应中CH4的转化率,可以采取的措施是 。
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为 。
(3)①Li2O、Na2O、MgO均能吸收CO2。①如果寻找吸收CO2的其他物质,下列建议合理的是_____。
A.可在碱性氧化物中寻找
B.可在ⅠA、ⅡA族元素形成的氧化物中寻找
C.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是 。
(4)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:CO2+H2O CO+H2+O2
CO+H2+O2
高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

CO2在电极a放电的反应式是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是
① SiO2 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.①③④ C.②③④ D.全部
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:实验题
(12分)实验室利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4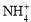 + 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
+ 6HCHO = 3H+ + 6H2O + (CH2)6N4H+
然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行如下实验:
[滴定时,1 mol (CH2)6N4H+与1 mol H+ 相当]
步骤Ⅰ:称取样品1.500 g
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
步骤Ⅳ:实验数据记录
<若NaOH标准溶液的浓度为0.1010 mol/L>
滴定次数 | 待测液的体积(mL) | 标准溶液的体积 | |
滴定前刻度(mL) | 滴定后刻度(mL) | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
根据上述实验步骤填空:
(1)滴定操作时,眼睛应观察
(2)滴定终点的判断方法是
(3)锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
(4)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分
数 (填“偏大”、“偏小”或“无影响”)
(5)配制样品溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、滴定管外,
还有 (填仪器名称)
(6)该样品中氮的质量分数为
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是

A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH-- 4e-=2H2O+O2↑
D.电解饱和食盐水的总反应是: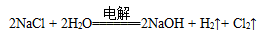
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
已知:CH3CH2CH2CH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);?H =-2878 kJ?mol-1
4CO2(g)+5H2O(l);?H =-2878 kJ?mol-1
(CH3)2CHCH3(g)+6.5O2(g) 4CO2(g)+5H2O(l);?H =-2869 kJ?mol-1下列说法正确的是
4CO2(g)+5H2O(l);?H =-2869 kJ?mol-1下列说法正确的是
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二上学期第三次月考化学试卷(解析版) 题型:选择题
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)====N2O4(g) ΔH=+8.7 kJ·mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
A.2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g) ΔH=-542.7 kJ·mol-1
B.2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g) ΔH=-1059.3 kJ·mol-1
C.2N2H4(g)+ N2O4(g) ====3N2(g)+4H2O(g) ΔH=-2153.4 kJ·mol-1
D.2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g) ΔH=-1076.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省乐清市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其化学方程式为: Cu(NH3)2Ac+CO+NH3  [Cu(NH3)3CO]Ac;若要提高上述反应的正反应速率,可采取的措施是
[Cu(NH3)3CO]Ac;若要提高上述反应的正反应速率,可采取的措施是
①增加NH3的浓度 ②降温 ③减压 ④及时移走产物
A.① B.②③ C.③④ D.①②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com