
分析 1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,结合物质的状态及焓变书写热化学方程式.
解答 解:1g氢气的物质的量为$\frac{1g}{2g/mol}$=0.5mol,即0.5molH2完全燃烧生成液态水时放出142.9kJ的热量,则2molH2完全燃烧生成液态水时放出热量为142.9kJ×4=571.6kJ,则该反应的热化学方程式是2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1,
故答案为:2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ•mol-1.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、热化学方程式的书写方法等为解答的关键,侧重分析与计算能力的考查,注意放热反应的焓变为负值,题目难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:实验题
| 假 设 | 操 作 | 现 象 | 原 理 |
| Na2S2O4为强碱弱酸盐,其溶液为碱性. | 取少量溶液于试管中,滴加 ②紫色石蕊试液 | 溶液变成蓝色 | S2O42-水解,使溶液成碱性 |
| ①Na2S2O4具有还原性 | 取少量溶液于试管中,滴加过量新制氯水,再滴加 BaCl2 溶液 | 有白色沉淀生成 | 该反应的离子方程式依次为:③4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+,④Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
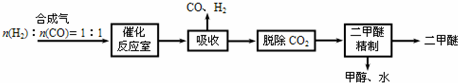
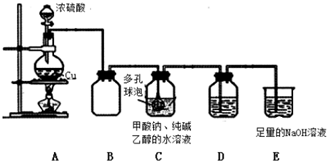
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
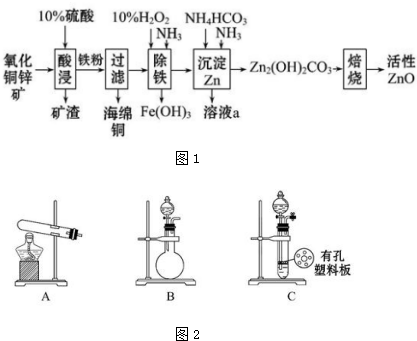
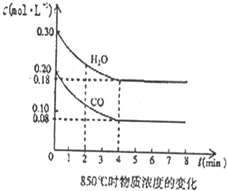
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
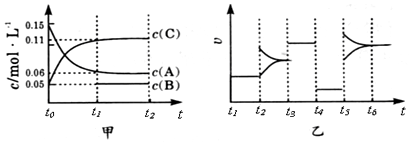
| A. | 该反应一定是放热反应 | B. | t4~t5阶段改变的条件为减小压强 | ||
| C. | B的起始物质的量为0.02mol | D. | 该反应的化学方程式为3A(g)+B(g)?2C(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com