
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液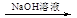 红褐色沉淀 红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | Br2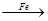 FeBr3 FeBr3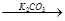 KBr KBr | 制备少量KBr溶液 |
| C | 无色试液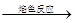 焰色呈黄色 焰色呈黄色 | 说明原溶液中一定不含钾元素 |
| D | H3PO3+2NaOH(足量)=Na2HPO3+2H2O | H3PO3属于三元酸 |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源:不详 题型:实验题
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 (E) KHSO4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸、硫酸 | B.盐酸、NaOH溶液 | C.氨水、硫酸 | D.氨水、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
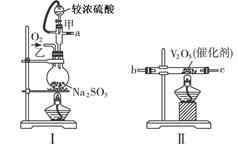
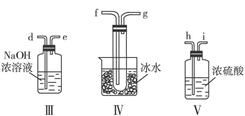
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
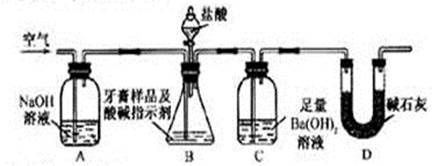
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;
③中溶液25.00ml,加入适量0.1%的A溶液作指示剂,立即用浓度为0.002000mol/L的硫代硫酸钠溶液滴定,并记录消耗硫代硫酸钠溶液的体积;| 序号 | 滴定前/mL | 滴定后/mL |
| ① | 1.35 | 19.40 |
| ② | 1.05 | 19.00 |
| ③ | 1.58 | 20. 91 91 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前有少量蒸馏水 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.在转移过程中有溶液撒在外面 |
| D.俯视确定凹液面与刻度线相切 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com