
| A. | Mg>Al | B. | S<P | C. | K<Cs | D. | Br<Cl |
分析 同主族自上而下第一电离能减小,同周期随原子序数增大,第一电离能呈增大趋势,当ⅡA、ⅤA族分别为全满、半满稳定状态,能量较低,第一电离能高于同周期相邻元素的.
解答 解:A.同周期随原子序数增大,第一电离能呈增大趋势,Mg原子3s能级为全满稳定状态,能量较低,第一电离能高于Al的,故A正确;
B.同周期随原子序数增大,第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于S的,故B正确;
C.同主族自上而下第一电离能减小,故第一电离能K>Cs,故C错误;
D.同主族自上而下第一电离能减小,故第一电离能Br<Cl,故D正确,
故选:C.
点评 本题考查同周期、同主族第一电离能递变规律,比较基础,理解掌握同周期第一电离能异常情况.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
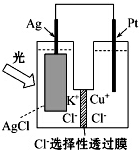 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
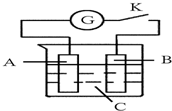 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| B. | 2.3 g钠在足量的氧气中燃烧,钠失去的电子数为0.2NA | |
| C. | 标准状况下,2g氢气所含原子数目为NA | |
| D. | 100mL0.2mol/L BaCl2溶液中Cl-的数目为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该样品中一定含有NH4HC03和NH4Cl | |
| B. | 该样品中含N元素的质量分数为17.57% | |
| C. | 该样品若和足量烧碱反应,将消耗0.4mol NaOH | |
| D. | 根据上述数据可以确定原样品中含有5.3g NH4N03 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com