
【题目】铁及其化合物在生产和生活中有广泛的应用。
(1)铁元素在元素周期表中的位置为________________。
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为__________;铁在高温条件下与水蒸气反应的化学方程式为______________________________________________________________。
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:

已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀(pH) | 2.3 | 7.5 | 3.4 |
完全沉淀(pH) | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为____________。
②碱式硫酸铁溶于水后产生的[Fe(OH)]2+,可部分水解生成聚合离子[Fe2(OH)4]2+。该水解反应的离子方程式为_______________________________。
(4)高铁酸钾(K2FeO4)也是常用的水处理剂。它的制备方法有多种。
①熔融法又称为过氧化钠氧化法。先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2===Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4===K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因:_________________________________________________________________。
②电解法制备高铁酸钾。铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备。阴极的电极材料为__________,写出阳极的电极反应式为_______________________________________________________。
【答案】 第四周期Ⅷ族 3∶4 3Fe+4H2O(g)![]() Fe3O4+4H2 4.4~7.5 2[Fe(OH)]2++2H2O
Fe3O4+4H2 4.4~7.5 2[Fe(OH)]2++2H2O![]() [Fe2(OH)4]2++2H+ K2FeO4溶解度小,析出结晶,促进反应进行 石墨 Fe-6e-+8OH-===FeO
[Fe2(OH)4]2++2H+ K2FeO4溶解度小,析出结晶,促进反应进行 石墨 Fe-6e-+8OH-===FeO![]() +4H2O
+4H2O
【解析】(1)铁是26号元素,在元素周期表中的位置为第四周期Ⅷ族;
(2)令Fe的物质的量为1mol,则:
Fe+2HCl=FeCl2+H2↑
1mol 1mol
3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
1mol 4/3mol
相同条件下体积之比等于物质的量之比,则两反应中生成氢气体积之比为1mol:4/3mol=3:4;
(3)①制备硫酸亚铁,应与硫酸铝分离,应调节溶液pH生成Al(OH)3,要避免生成应Fe(OH)2沉淀,控制pH在4.4~7.5之间;②[Fe(OH)]2+离子,可部分水解生成[[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O![]() [Fe2(OH)4]2++2H+;
[Fe2(OH)4]2++2H+;
(4)①复分解反应的条件是生成沉淀、气体或者弱电解质,因为K2FeO4溶解度小,析出晶体,促进反应进行;②铁发生氧化反应作阳极,所以阴极是石墨,铁转化为FeO42-,因此电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. ZnS晶胞中,Zn2+的配位数为4,距离Zn2+最近且等距的Zn2+有12个
B. 在CaF2晶胞中,F-采取A1型最密堆积,F-的配位数为4
C. 金刚石晶体中,最小的环为12元环,每个碳原子被6个环所共有
D. 冰晶体属于分子晶体,其遵循密堆积原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。
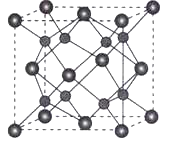
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是( )

A. 工业上以黏土、石灰石和石英为主要原料来制造普通水泥
B. 负极的电极反应式为:2Cu+2OH﹣﹣2e﹣=Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,容积为1L的密闭容器中发生反应:
SiF4(g)+2H2O(g)![]() SiO2(s)+4HF(g) △H="+148.9" kJ·mol-1
SiO2(s)+4HF(g) △H="+148.9" kJ·mol-1
下列各项中不能说明该反应已达化学平衡状态的是( )
A. v(SiF4)消耗=4v(HF)生成 B. HF的体积分数不再变化
C. 容器内气体压强不再变化 D. 容器内气体的总质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常见的二次电池,目前汽车上使用的电瓶大多数是铅蓄电池。已知铅蓄电池的电解质溶液为硫酸溶液,其充、放电按下式进行:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1),下列有关该电池的说法正确的是
2PbSO4(s)+2H2O(1),下列有关该电池的说法正确的是
A. 放电时,溶液中H+向PbO2电极迁移
B. 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g
C. 充电时,电解质溶液的pH增大
D. 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com