
| 有机物 | 氢氧化钠 | 银氨溶液 | 新制氢氧化铜 | 金属钠 |
| A | 发生中和反应 | 不反应 | 溶解 | 放出氢气 |
| B | 不反应 | 发生银镜反应 | 生成红色沉淀 | 放出氢气 |
| C | 不反应 | 发生银镜反应 | 生成红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
分析 A能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH;B能发生银镜反应,说明含有-CHO,能与Na发生生产氢气,说明含有-OH;C能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯;D能水解,含有酯基,结合分子式可确定有机物的结构简式.
解答 解:A能与NaOH发生中和反应且能溶解Cu(OH)2,说明含有-COOH,应为CH3CH2COOH;B能发生银镜反应,说明含有-CHO,能与Na发生生产氢气,说明含有-OH,应为CH3CHOHCHO或CH2OHCH2CHO;C能发生水解,且能发生银镜反应,说明含有-OOCH,为甲酸酯,应为HCOOCH2CH3,名称为甲酸乙酯,D能水解,含有酯基,应为CH3COOCH3,名称为乙酸甲酯,
故答案为:CH3CH2COOH;CH3CHOHCHO;HCOOCH2CH3;CH3COOCH3.
点评 本题考查有机物的推断,为高频考点,题目难度不大,解答本题时可先根据有机物的分子式写出可能的同分异构体的结构简式,根据有机物的性质判断可能的结构,注意把握有机物官能团的性质.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
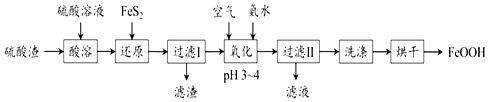
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
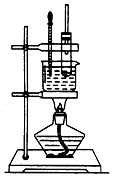 实验室制备硝基苯的实验装置如图所示,填写下列空白:
实验室制备硝基苯的实验装置如图所示,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | FeCl2溶液中混有少量的FeCl3:加入足量的铁粉后过滤 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6.-2 | -1 | -1 |
| A. | 气态氢化物的稳定性HG>HF>H2E | |
| B. | B2+、D3+、E2-、G-四种离子的核外电子排布相同 | |
| C. | A、E元素与氧元素可以形成三种常见的含氧酸盐 | |
| D. | C元素的原子最外层电子数等于电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1 135.7 kJ•mol-1 | B. | 601.7 kJ•mol-1 | ||
| C. | -466.3 kJ•mol-1 | D. | 1 000.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
| A. | 五种物质在常温下溶解度最大的是Ag 2SO4 | |
| B. | 将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀 | |
| C. | 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 | |
| D. | 常温下,AgCl、AgBr和AgI三种物质的溶解度逐渐增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com