
DAP是电器和仪表部件中常用的一种合成高分子化合物,它的结构简式为:

则合成此高分子的单体可能是 ( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2 ③丙烯醇HOCH2CH=CH2
④ 邻苯二甲酸 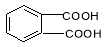 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 
A.①② B.③④ C.②④ D.③⑤
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年河北省邯郸市高一下期中化学试卷(解析版) 题型:选择题
同温同压,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是( )
H2(g)+I2(g),达到平衡状态的标志是( )
A.颜色保持不变
B.气体密度保持不变
C.2v正(HI)=v逆(I2)
D.拆开2 mol H﹣I共价键,同时生成1 mol H﹣H共价键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二6月月考化学试卷(解析版) 题型:选择题
以下反应最符合绿色化学原子经济性要求的是( )
① 乙烷与氯气制备一氯乙烷
② 乙烯聚合为聚乙烯高分子材料
③ 苯和硝酸反应制备硝基苯
④ 乙烯与氧气在银催化作用下生成环氧乙烷(C2H4O)
A. ①④ B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省南阳市五校高二第二次联考化学试卷(解析版) 题型:选择题
下列实验能获得成功的是( )
A、用溴水可鉴别苯、CCl4、苯乙烯
B、加浓溴水,然后过滤可除去苯中少量苯酚
C、苯、溴水、铁粉混合制成溴苯
D、可用分液漏斗分离乙醇和水
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省南阳市五校高二第二次联考化学试卷(解析版) 题型:选择题
下列系统命名法正确的是 ( )
A.2-甲基-4-乙基戊烷 B.2,3-二乙基-1-戊烯
C.2-甲基-3-丁炔 D.对二甲苯
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一下学期5月月考化学试卷(解析版) 题型:推断题
部分短周期元素的原子结构及相关性质如表所示:
元素编号 | 元素性质或原子结构 |
T | 最高正价与最低负价的代数和为4 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 最高正价是+7价 |
(1)T在元素周期表中的位置为 ______。
(2)X的一种同位素可用于测定文物年代,该同位素为 ______ (用原子符号表示)。
(3)Z单质的电子式为____ ;Y的氢化物的水溶液显碱性的原因为_____(用离子方程式表示)。
(4)Z与T相比,非金属性较强的是__(用元素符号表示),下列能证明这一事实的是 (填字母)
a.常温下,Z单质为气体,T单质为固体
b.Z的氢化物的水溶液的酸性比T强
c.Z的最高正价比Y高
d.最高价氧化物对应水化物的酸性Z比T强
(5)Z的氢化物与Y的氢化物发生反应的化学方程式为 ,产物中含有的化学键类型为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高一下学期5月月考化学试卷(解析版) 题型:选择题
如图中的有机化合物可能发生的化学反应有( )
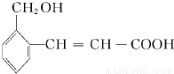
①加成 ②氧化 ③加聚 ④取代
A.①②
B.①③④
C.①②④
D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二6月月考化学试卷(解析版) 题型:填空题
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:  。
。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式: 。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为 mol。
6Cu+SO2,该反应的还原剂是 ;当生成19.2 g Cu时,反应中转移的电子为 mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式: 。
(5)研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式: 。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3===2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏高一下学期期中考试化学试卷(解析版) 题型:实验题
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验。
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为____
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律:
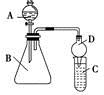
(3)仪器B的名称为________,干燥管D的作用为____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_________________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有_______溶液的洗气瓶除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com