
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:
①Na2S+H2O+SO2→Na2SO3+S
②2H2S+SO2→3S↓+2H2O
③S+Na2SO3![]() Na2S2O3
Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________________,则整个装置气密性良好。装置D的作用是_________。装置E中为_________溶液。
(2)装置B可用于观察SO2的生成速率,其中的液体最好选择_________。
a.饱和食盐水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是__________。
(3)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_________________。
(4)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_________(Na2S2O3·5H2O式量248)
【答案】一段时间内保持不变 防倒吸 NaOH c 溶液变澄清 加入盐酸,Na2S2O3反应S沉淀,所以静置后取上层清液,滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质 0.64
【解析】
(1)利用液面差在一段时间内不变检验装置的气密性;有缓冲装置能防止倒吸;二氧化硫有毒不能直接排空,应该用碱液吸收;
(2)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;观察SO2的生成速率,发生强酸制取弱酸的反应,为使SO2缓慢进入烧瓶C,应控制B中硫酸的加入速度,③中发生S(g)+Na2SO3(aq)=Na2S2O3(aq),反应达到终点是S完全溶解;
(3)检测产品中是否存在Na2SO4,先加盐酸排除干扰,再利用氯化钡检验硫酸根离子;
(4)根据产率=实际质量/理论质量×100%进行计算。
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,说明不漏气,则气密性良好;D中左侧为短导管可防止液体倒吸;E中盛放NaOH溶液进行尾气处理,防止含硫化合物排放在环境中,从而保护环境;
(2)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;③中发生S(g)+Na2SO3(aq)=Na2S2O3(aq),反应达到终点是S完全溶解,可观察到溶液变澄清(或浑浊消失);
(4)检测产品中是否存在Na2SO4,取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质;
(5)由①Na2S+H2O+SO2→Na2SO3+H2S可知,0.08mol硫化钠生成0.08mol硫化氢和0.08mol亚硫酸钠,由②2H2S+SO2→3S↓+2H2O可知,0.08mol硫化氢反应生成0.12mol硫单质,由③S+Na2SO3=Na2S2O3可知,0.12mol硫单质生成0.12mol硫代硫酸钠,所以产率是![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下,a L密闭容器中放入1molN2和3molH2发生N2+3H2![]() 2NH3的反应,下列选项中能说明反应已达到平衡状态的是
2NH3的反应,下列选项中能说明反应已达到平衡状态的是
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.2v(H2)=3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
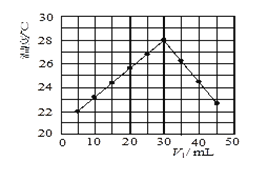
(1)研究小组做该实验时环境温度__________(填“高于”、“低于”或“等于”)22 ℃,判断的依据是____________
(2)由题干及图形可知,V1/V2=__________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为___________mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q kJ的热量,请写出此反应的热化学方程式:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔为原料在不同条件下可以合成多种有机物.
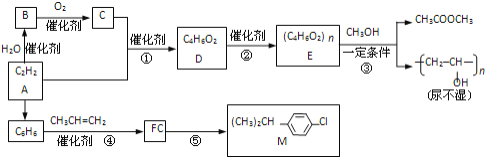
已知:①CH2=CHOH(不稳定)![]() CH3CHO
CH3CHO
②一定条件下,醇与酯会发生交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
完成下列填空:
(1)写反应类型:③__反应;④__反应.反应⑤的反应条件__.
(2)写出反应方程式.B生成C__;反应②__.
(3)R是M的同系物,其化学式为![]() ,则R有__种.
,则R有__种.
(4)写出含碳碳双键、能发生银镜反应且属于酯的D的同分异构体的结构简式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S能定量完成下列反应:R-+H2S(少量)![]() HR + HS-, 2Z-+ H2S(少量)
HR + HS-, 2Z-+ H2S(少量)![]() 2HZ + S2-。下列叙述正确的是
2HZ + S2-。下列叙述正确的是
A.相同温度下电离平衡常数:Ki1(H2S)>Ki(HZ)>Ki2(H2S)>Ki(HR)
B.结合H+的能力:Z->S 2->R->HS-
C.同温同浓度下,溶液的pH值:NaHS>NaR>Na2S>NaZ
D.HZ与Na2S反应的离子方程式:HZ +S2-![]() HS-+ Z-
HS-+ Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
(1)实验①反应后的溶液pH=9的原因是___(用离子方程式表示)。
(2)实验①和实验②中水的电离程度较大的是__,该溶液中由水电离出的c(OH-)=__。
(3)x__0.2(填“>”“<”或“=”),若x=a,则室温下HA的电离平衡常数Ka=__(用含a的表达式表示)。
(4)若用已知浓度的KOH滴定未知浓度的一元酸HA,滴定终点的判断方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是
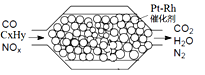
A. 尾气造成“雾霾”与汽油未充分燃烧有关
B. 尾气处理过程,氮氧化物(NOX)被还原
C. Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D. 使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“立方烷”是新合成的一种烃,其分子为正立方体结构。
(1)“立方烷”的分子式是_____。
(2) “立方烷”分子中可能有的结构是_____。(从A、B、C、D中选)。
A.![]()
B.![]()
C.
D.![]()
(3) “立方烷”可能发生的反应或变化有_____。(从A、B、C、D中选)。
A.可使Br2水褪色,但不反应
B.不能使溴的CCl4溶液褪色
C.能发生取代反应
D.能发生加成反应
(4) “立方烷”的一种同分异构体为芳香烃,此芳香烃能发生加聚反应,其结构简式为_____,发生的加聚反应化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
(2)酸浸净化后的废铁屑:将2gFe粉、10mL3mol·L-1的H2SO4溶液加入烧瓶中反应,用如图所示装置制备FeSO4溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
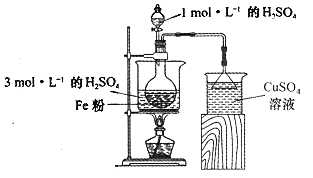
①反应过程中会产生少量H2S、PH3等气体,需使用封闭装置。写出用CuSO4溶液吸收H2S气体的化学反应方程式:____________________________
②反应过程中使用过量铁粉的目的是____________________________
(3)制备(NH4)2Fe(SO4)2·6H2O:向FeSO4溶液中加入一定质量的(NH4)2SO4固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量Cl2:Fe2+、H+、NH4+、Clˉ、SO42ˉ
B.加入过量KSCN溶液:K+、NH4+、Fe3+、SO42ˉ、SCNˉ
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42ˉ、OHˉ
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42ˉ、Clˉ、ClOˉ、OHˉ
(4)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为cmol·L-1的酸性KMnO4溶液滴定。重复上述操作2次实验结果如下:

该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中SO42ˉ的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2mol·L-1的HCl溶液、BaCl2溶液、AgNO3溶液)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com