
分析 依据n=$\frac{N}{N{\;}_{A}}$=$\frac{m}{M}$=$\frac{V}{Vm}$,结合物质的结构组成解答.
解答 解:依据N=nNA,可知物质的量与分子数成正比,
A.标准状况下33.6LCO物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol;
B.1个氢气分子含有2个电子,则所含电子为4mol的H2,含有氢气分子的物质的量为2mol;
C.20℃时45gH2O,水分子的物质的量为:$\frac{45g}{18g/mol}$=2.5mol;
D.常温下,0.5NA个CO2与0.5NA个CO的混合气体,物质的量为$\frac{0.5{N}_{A}+0.5{N}_{A}}{N{\;}_{A}}$=1mol;
所以下列物质所含分子数由多到少的顺序是:C>B>A>D.
故答案为:C>B>A>D.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、阿伏伽德罗常数之间的关系即可解答,注意掌握密度与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
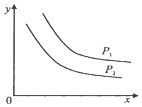 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强P1>P2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )| A. | 上述反应是放热反应 | B. | 上述反应是吸热反应 | ||
| C. | a>b | D. | a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
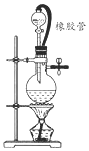 在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )
在氯气的制备实验中,有位同学设计了如图所示的制备装置,其中分液漏斗与烧瓶瓶塞之间连接一段橡胶管和玻璃管.下列对其作用的叙述中正确的是( )| A. | 防止氯气造成大气污染 | |
| B. | 使反应的氯气循环使用 | |
| C. | 使烧瓶内的压强与大气压保持一致 | |
| D. | 使分液漏斗中的液体更容易注入烧瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaCl固体,v(H2)不变 | B. | 加入少量水,v(H2)减小 | ||
| C. | 加入少量CH3COONa固体,v(H2)不变 | D. | 加入少量CuSO4溶液,v(H2)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NaOH═Na2SO3+H2O | B. | 3NO2+2H2O═2HNO3+NO | ||
| C. | 3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | D. | 2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
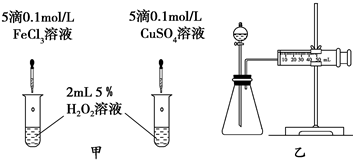
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com