
【题目】化学科学的发展离不开物质结构的探索和研究。物质结构研究对于保护生态环境、实现社会的可持续发展有重要的意义。请回答下列问题:
(1)基态铜原子最外层电子所占用能级的电子云轮廓图形状为_____,基态硒原子的价电子排布图为____。
(2)次氯酸分子的VSEPR模型名称为_______,中心原子的杂化类型为_________。
(3)C、O、F三者的第一电离能由小到大的顺序为___________。
(4)CaO的熔点比BaO(填“高”或“低”),原因是______。
(5)H2SeO4的酸性比H2SeO3强,原因是_________。
(6)与CN-互为等电子体的离子有________(写出一种即可)。
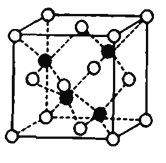
(7)Fe和S形成的某种晶胞如图所示:其中白球表示S,黑球表示Fe,则该物质的化学式为_______.该晶胞中硫原子的配位数为_______;假设该晶胞的密度为ρg/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为__________pm.
【答案】 球形 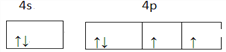 四面体型 sp3 杂化 C<O<F 高,Ca2+ 半径比Ba2+小,CaO的晶格能比BaO大 H2SeO4 和H2SeO3 可用(HO)mSeOn, H2SeO4 中的n值大,Se的正电性高导致Se-O-H中O的电子向Se偏移,在水分子的作用下更容易电离出H + ,所以酸性更强(或者说H2SeO4 中非羟基氧数目多,所以酸性更强也得分) O22+ 或 C22- FeS 4
四面体型 sp3 杂化 C<O<F 高,Ca2+ 半径比Ba2+小,CaO的晶格能比BaO大 H2SeO4 和H2SeO3 可用(HO)mSeOn, H2SeO4 中的n值大,Se的正电性高导致Se-O-H中O的电子向Se偏移,在水分子的作用下更容易电离出H + ,所以酸性更强(或者说H2SeO4 中非羟基氧数目多,所以酸性更强也得分) O22+ 或 C22- FeS 4 ![]() ×1010
×1010
【解析】(1)基态Cu原子核外有4个电子层,最高能层为第四层,即N层,最外层电子为4s1电子,该能层电子的电子云轮廓图形状为球形,硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4,价层电子排布图为![]() 故答案为:球形;
故答案为:球形;![]() ;
;
(2)次氯酸分子中中心原子O有2对孤对电子和2个σ键,VSEPR模型为四面体,O原子采取sp3杂化,故答案为:四面体;sp3杂化;
(3)同一周期中,元素的第一电离能随着原子序数的增大而增大,所以C、O、F元素第一电离能为C<O<F, 故答案为:C<O<F;
(4)离子晶体中离子半径越小,则离子键键能越大,其晶体的晶格能越大,熔点越高,已知钙离子半径小于钡离子半径,所以CaO的熔点高于BaO,故答案为:高;Ca2+ 半径比Ba2+小,CaO的晶格能比BaO大;
(5)H2SeO4中非羟基氧数目多,所以酸性更强,即H2SeO4的酸性比H2SeO3强,故答案为:H2SeO4中非羟基氧数目多,所以酸性更强;
(6)将CN-中C原子及1个负电荷换成1个N原子,可得等电子体N2,将N原子及1个负电荷换成1个O原子,可得等电子体CO,同理互为等电子体的离子有O22+或C22-等,故答案为:O22+(或C22-);
(7)黑球铁处于晶胞内部,晶胞中含有4个Fe原子,白球S处于顶点和面心,晶胞中含有S原子数目为6×![]() +8×
+8×![]() =4,约成最简整数比既得化学式为FeS,根据图示,每个铁原子周围有四个硫原子,即晶胞中铁原子的配位数为4,则硫原子的配位数也为4;晶胞质量为4×
=4,约成最简整数比既得化学式为FeS,根据图示,每个铁原子周围有四个硫原子,即晶胞中铁原子的配位数为4,则硫原子的配位数也为4;晶胞质量为4×![]() g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×
g,假设该晶胞的边长为a cm,则(a cm)3×ρ g/cm3=4×![]() g,则a=
g,则a=![]() ,距离最近的S原子之间距离为晶胞边长的
,距离最近的S原子之间距离为晶胞边长的![]() ,故S原子之间距离为
,故S原子之间距离为![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:FeS;4;
×1010pm,故答案为:FeS;4;![]() ×
×![]() ×1010。
×1010。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
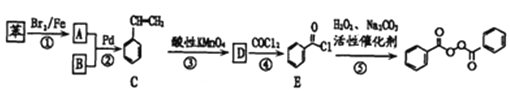
【题目】各地对食品非法添加和滥用添加剂进行了多项整治活动。其中常用的面粉增白剂过氧化苯甲酰(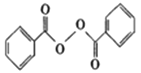 )也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
)也被禁用。下面是一种以苯为原料合成过氧化苯甲酰的流程:
已知:![]()
请回答下列问题:
(1)工业上物质B主要来源于_____,物质D的名称是_______;每个C分子中最多有____个原子共平面。
(2)结合过氧化苯甲酰结构分析,过氧化苯甲酰可以作为增白剂的原因是________。
(3)写出反应②的化学方程式________,反应类型为________。
(4)某物质F为过氧化苯甲酰的同分异构体,同时符合下列条件的F的同分异构体有______种,请写出其中有三种不同化学环境的氢原子的结构简式:____________。
① 含有联苯(![]() )结构单元.无其他环状结构
)结构单元.无其他环状结构
② 在一定条件下能发生银镜反应
③ 1mol F最多可消耗4mol NaOH
(5)请写出以苯乙烯为原料,合成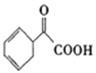 的流程,无机试剂任选,注明反应条件。____________
的流程,无机试剂任选,注明反应条件。____________
示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有相同量NaOH溶液的烧杯中通入不同量的CO2气体,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发),则下列分析都正确的组合是

对应图象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
A.NaCl、Cl2
B.NaHCO3、蔗糖
C.Ba(OH)2、HCl
D.H2SO4、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的稀HNO3溶液中,收集到NO气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42- )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g.则V可能为
A. 5.5L B. 6.0L C. 8.96L D. 11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图示的说法中正确的是 ( )




① ② ③ ④
A. 用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B. 用图②所示实验装置排空气法收集CO2气体
C. 图③表示可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的△H>0
CO2(g)+H2(g)的△H>0
D. 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期过渡元素常与H2O、NH3等形成配合物。
(1)写出Fe元素基态原子的价层电子排布式_______;
(2)C、N、O元素的第一电离能从大到小的顺序为___(用元素符号表示);
(3)向盛有硫酸铜水溶液的试管里加入过量氨水,得到蓝色溶液,铜离子形成了配位数为4的配离子,写出该配离子的结构式为______。
(4)由C、H、O、S中任两种元素构成甲、乙、丙三种分子,所含原子的数目依次为3、4、8,都含有18个电子。甲和乙的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
甲 | 187 | 202 | 2.6 |
乙 | 272 | 423 | 以任意比互溶 |
①甲分子的电子式为_________,分子构型为___________;
②1 mol乙分子含有___个σ键;
③丙分子的中心原子采取_______杂化轨道;
④甲和乙的相对分子质量基本相同,造成上述物理性质差异的主要原因是 ____________(结合具体物质解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化还原反应中,实际参加反应的氧化剂与还原剂的物质的量之比正确
①KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O;1∶6
②Fe2O3+2Al![]() Al2O3+2Fe;1∶2
Al2O3+2Fe;1∶2
③SiO2+3C![]() SiC(硅为+4价)+2CO↑;1∶2
SiC(硅为+4价)+2CO↑;1∶2
④3NO2+H2O===2HNO3+NO;2∶1
A. ①③ B. ②③ C. ②④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com