
| A. | 离子化合物中可能含有非极性键 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 原子晶体中可能含有非极性键 | |
| D. | 氯化钠晶体熔化时离子键发生断裂 |
分析 A.含有离子键的化合物是离子化合物,离子化合物一定含有离子键,也可以含有共价键;
B.原子晶体不存在分子间作用力;
C.如为单质,则存在非极性键;
D.氯化钠为离子晶体,含有离子键.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物一定含有离子键,也可以含有共价键例如:草酸钠、苯酚钠内含有的都存在C-C非极性键和C-O、C-H之间的极性键,故A正确;
B.原子晶体不存在分子间作用力,决定熔点高低的因素为共价键,故B错误;
C.原子晶体中,金刚石等存在非极性键,故C正确;
D.氯化钠为离子晶体,含有离子键,熔化时离子键发生断裂,故D正确.
故选B.
点评 本题考查物质和化学键的关系、分子极性与化学键的关系,侧重考查学生对知识点的区分能力,根据基本概念、物质结构分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1molN2和3mol H2充分反应,生成物中的 N-H键的数目为6NA | |
| B. | 23g NO2和 N2O4的混合物中原子总数为1.5NA | |
| C. | 1L 0.1mol•L-1的Na2S溶液中S2- 与 HS- 的总数为0.1NA | |
| D. | 向FeI2溶液中通入适量的氯气,当有1molFe2+被氧化时,总共转移电子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中混合气体的密度不变 | B. | 密闭容器中c(NH3):c(CO2)=2:1 | ||
| C. | 2v(NH3)=v(CO2) | D. | 密闭容器中氨气的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和乙醇的混合液(3:1)加热至140℃ | |
| B. | 浓硫酸和苯的混和液加热至80℃ | |
| C. | 煮沸氯乙烷和苛性钾溶液 | |
| D. | 煮沸氯乙烷和苛性钾的醇溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
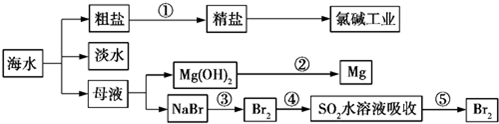
| A. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | ②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段 | |
| C. | ③④⑤中溴元素均被氧化 | |
| D. | 蒸馏法是技术最成熟也是最具发展前景的海水淡化方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+2H2O?H2CO3+2NaOH | B. | NH3•H20?NH4++OH- | ||
| C. | CH3COOH?H++CH3COO- | D. | Na2SO3+H2O?NaHS03+NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| B. | 乙醛和乙酸都含有碳氧双键,二者都能发生加成反应 | |
| C. | 苯可以发生加成反应,但苯中不含有碳碳双键 | |
| D. | 乙醇和苯酚都含有羟基都能发生酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com