
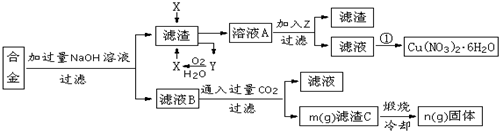
分析 含有铝、铁、铜的废弃合金加入过量氢氧化钠溶液过滤得到滤渣B为Cu、Fe,滤液为NaAlO2溶液,通入过量的二氧化碳生成氢氧化铝和碳酸氢钠溶液;滤渣中加入X生成Y和溶液A,Y通入氧气反应生成X,判断X为HNO3,Y为NO气体,溶液A为Fe(NO3)3,Cu(NO3)2,加入Z调节溶液PH使铁离子沉淀得到滤渣E为Fe(OH)3,滤液通过蒸发浓缩,冷却结晶,过滤洗涤得到硝酸铜晶体;
(1)合金中只有铝与加入NaOH溶液反应,所以离子方程式为:2Al+2OH?+2H2O═2 AlO2?+3H2↑;
(2)铁离子完全沉淀,而铜离子不能沉淀,所以PH控制在3.2≤pH<4.7,除杂不能引入新的杂质;
(3)从硝酸铜溶液中得到硝酸铜晶体应采用蒸发浓缩、降温结晶、过滤洗涤即可得硝酸铜晶体;
(4)测定Cu(NO3)2•nH2O里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硝酸铜结晶水的含量,注意硝酸铜受热分解产物为氧化铜,据此分析判断;
(5)根据差量计量氢氧化铝的质量,然后根据质量分数为:$\frac{氢氧化铝的质量}{滤渣的总质量}×100%$,来求解;
(6)可能是碳酸氢钠的溶解度小而析出到滤渣中,或者烘干不到位的因素造成.
解答 解:(1)合金中只有铝与加入NaOH溶液反应,所以离子方程式为:2Al+2OH?+2H2O═2 AlO2?+3H2↑,由分析可知X是硝酸,故答案为:2Al+2OH?+2H2O═2 AlO2?+3H2↑,硝酸;
(2)铁离子完全沉淀,而铜离子不能沉淀,所以PH控制在3.2≤pH<4.7,除杂不能引入新的杂质,加入铜粉将铁离子还原成亚铁离子,而氨水引入铵根离子,硝酸铜溶液起不到调节PH的作用,所以只能用氧化铜,故答案为:3.2≤pH<4.7;c;
(3)从硝酸铜溶液中得到硝酸铜晶体应采用蒸发浓缩、降温结晶、过滤洗涤即可得硝酸铜晶体,故答案为:蒸发浓缩、降温结晶;
(4)Cu(NO3)2受热易分解,其分解反应为:2Cu(NO3)2$\frac{\underline{\;加热\;}}{\;}$2CuO+4NO2↑+O2↑.
a.称量样品→加热→冷却→称量CuO,根据硝酸铜分解的方程式以及氧化铜的质量可测定Cu(NO3)2•nH2O的结晶水含量,故a不选;
b.因硝酸铜易分解,称量样品→加热无法恰好使结晶水合物恰好分解为硝酸铜,故b选;
c.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量,原体系中水蒸气也被吸收,故c选;
d.称量样品→加NaOH将硝酸铜转化为氢氧化铜,→过滤→加热氢氧化铜分解生成氧化铜→冷却→称量CuO,根据铜原子守恒求解无水硝酸铜的质量,据此求解结晶水含量,故d不选;
故选bc;
(5)由2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$ Al2O3+3H2O可知水的质量为:(m-n)g,所以氢氧化铝的质量为:$\frac{78×2}{3×18}×(m-n)$,所以质量分数为:$\frac{\frac{78×2}{3×18}×(m-n)}{m}×100%$=$\frac{26(m-n)}{9m}$,故答案为:$\frac{26(m-n)}{9m}$;
(6)滤渣C没有洗涤,混有NaHCO3,滤渣C洗涤后未烘干或烘干不达标,故答案为:滤渣C没有洗涤,混有NaHCO3,煅烧后失重偏大;滤渣C洗涤后未烘干或烘干不达标,混有微量水,煅烧后失重偏大.
点评 本题考查了物质分离提纯的方法分析,流程理解应用,掌握基础,实验基本操作是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
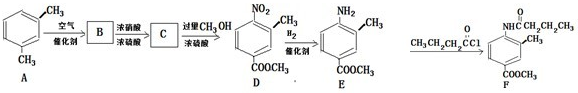
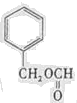
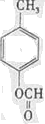
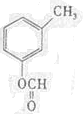
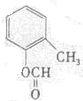 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若M与W组成原子数为1:1、1:2型离子化合物,则W2G的水溶液含7种粒子 | |
| B. | 若W单质在QM2气体中燃烧生成黑色、白色两种固体,则W的原子序数与族序数之比为5 | |
| C. | 若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,M与W组成的化合物易升华 | |
| D. | 若M与W组成的化合物作光导纤维材料,则W单质及其氧化物都抗所有酸溶液的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 自来水生成流程示意图
自来水生成流程示意图查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: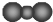 | B. | N原子最外层轨道表示式: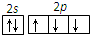 | ||
| C. | Cl原子的结构示意图: | D. | Al原子最外层电子排布式:3s23p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| B. | 向酒精灯内添加酒精时,酒精量不能超过酒精灯容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水浇灭 | |
| C. | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液的红色变浅,则证明Na2CO3溶液中存在水解平衡 | |
| D. | 在“金属析氢腐蚀”的对比实验中,外面缠绕着铜丝的铁钉上产生气泡多,若滴加几滴KSCN溶液,则在铁钉周围出现血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com