
分析 (1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,据此写出该反应的热化学方程式;
(2)根据n=$\frac{V}{{V}_{m}}$计算出标准状况下11.2L乙硼烷的物质的量,然后根据热化学方程式计算出完全燃烧放出的热量.
解答 解:(1)0.3mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5KJ的热量,则1mol气态高能燃料乙硼烷在氧气中燃烧,生成固态三氧化二硼和液态水,放出2165KJ的热量,反应的热化学方程式为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol,
故答案为:B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol;
(2)标准状况下,11.2L乙硼烷的物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,
根据热化学方程式B2H6(g)+3O2(g)═B2O3(s)+3H2O(l)△H=-2165kJ/mol可知,0.5mol乙硼烷完全燃烧放出的热量为:2165kJ/mol×0.5mol=1082.5kJ,
故答案为:1082.5.
点评 本题考查了热化学方程式的书写及计算,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握焓变的含义及应用,试题有利于提高学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
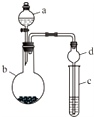 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: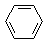 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$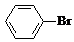 +HBr.能证明该反应是取代反应,而不是加成反应的操作和现象取反应后上层清液加硝酸银溶液,产生浅黄色沉淀.
+HBr.能证明该反应是取代反应,而不是加成反应的操作和现象取反应后上层清液加硝酸银溶液,产生浅黄色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
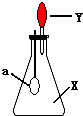 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是SO2,Y是KOH浓溶液 | ||
| C. | X是CO2,Y是稀盐酸 | D. | X是HCl,Y是NaCl稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
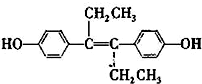 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )| A. | 已烯雌酚的分子式为C18H20O2,它为芳香族化合物 | |
| B. | 已烯雌酚分子中一定有16个碳原子共平面 | |
| C. | 1 mol已烯雌酚可以与5 mol Br2发生反应 | |
| D. | 已烯雌酚能发生加成、取代、氧化、加聚、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com