
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。

(1)图I是实验室制取蒸馏水的常用装置,仪器A的名称是________________,加热A时要加垫石棉网,目的是_______________。
(2)水的流向是否正确?________(填“正确”或“不正确”)
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是____________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图I完全相同。该装置中使用的玻璃导管较长,其作用是________________。
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:

(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2X(g) ![]() Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 ℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 ℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 ℃ | c | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 ℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法不正确的是( )
A. c>1.0
B. 实验2可能使用了催化剂
C. 实验3比实验2先达到化学平衡状态
D. 前10分钟,实验4的平均化学反应速率比实验1的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换膜法为目前普遍使用的制碱技术,其生产流程如图l所示:

(1)氯碱工业中需用精制的食盐水,精制食盐水的目的是_________________________________。由于粗盐水中含有Ca2+、Mg2+、![]() 等无机杂质,在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式_______________________________。
等无机杂质,在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式_______________________________。
(2)该流程中可以循环的物质是__________。(写物质名称)
(3)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为___________________________。
(4)图2是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是__________,C电极的名称是__________。采用无隔膜电解食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为________________________。
(5)已知在电解槽中,每小时通过I安培的直流电可以产生a克的烧碱。某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液b吨,电解槽的电流强度c安,该电解槽的电解效率为__________(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CH4和CO2可以制造价值更高的化学产品。已知:
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO2(g)+2H2O(g) ΔH 1=a kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH 2=b kJ/mol
CO2(g)+H2(g) ΔH 2=b kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH 3=c kJ/mol
2CO2(g) ΔH 3=c kJ/mol
(1)求反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH = kJ/mol(用含a、b、c的代数式表示)。
2CO(g)+2H2(g) ΔH = kJ/mol(用含a、b、c的代数式表示)。
(2)一定条件下,等物质的量的(1)中反应生成的气体可合成二甲醚(CH3OCH3),同时还产生了一种可参与大气循环的无机化合物,该反应的化学方程式为 。
(3)用Cu2Al2O4做催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
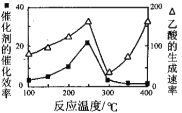
①250~300℃时,乙酸的生成速率降低的原因是 。
②300~400℃时,乙酸的生成速率升高的原因是 。
Ⅱ.钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2Sx )分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
Na2Sx ![]() 2Na+xS (3<x<5)
2Na+xS (3<x<5)
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |

(4)根据上表数据,判断该电池工作的适宜温度应为 (填字母序号)。
A.100℃以下
B.100℃~300℃
C.300℃~350℃
D.350℃~2050℃
(5)关于钠硫电池,下列说法正确的是 (填字母序号)。
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为![]() 2e
2e![]() xS
xS
(6)25℃时,若用钠硫电池作为电源电解500mL 0.2mol/L NaCl溶液,当溶液的pH变为13时,电路中通过的电子的物质的量为 mol,两极的反应物的质量差为 g。(假设电解前两极的反应物的质量相等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. SO2能使酸性KMnO4溶液迅速褪色
B. 可以用澄清石灰水鉴别SO2和CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药.已知:乙醚沸点为35℃.从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法.乙醚浸取法的主要工艺为如图1:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____.
(2)操作I需要的玻璃仪器主要有:烧杯、_____,为加速操作I的进行,最好采用_____的方法,操作Ⅱ的名称是_____.
(3)操作Ⅲ的主要过程可能是_____(填字母).
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用如图2实验装置测定青蒿素分子式的方法如下:
将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算.
①装置E中盛放的物质是_____,装置F中盛放的物质是_____.
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_____.
③用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
则测得青蒿素的最简式是_____.
(5)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与_____(填字母)具有相同的性质.
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如图3所示,由图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_____.
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010 年 1 月 4 日,所罗门群岛连续发生里氏 6.5 级和里氏 7.2 级地震以及多次余震,引发海啸,部分海域浪高 2.5 米,造成大约 1000 人无家可归.
(1)有人计算后表明,造成海啸的海底地震的能量相当于 3000 颗广岛原子弹爆炸的能量. 235U 是制 造原子弹的材料之一,它的质子数与中子数之差是____________,它与 238U 互称____________。
(2)随着灾民生活的渐渐稳定,工业生产也将逐渐恢复,现有一氯碱厂,按下面的流程生产:
![]()
上图的流程中,电解饱和食盐水的化学方程式是______________,请写出 Cl2 的检验方法____________,在工业上,将电解饱和食盐水得到的气体通入______________中合成氯化氢,_____________燃烧时火焰呈_______________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。

(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com