
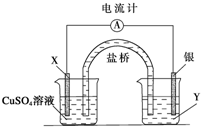
 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO在平衡时转化率为10% |
| B、平衡浓度c(CO2)=c(H2) |
| C、平衡时气体平均相对分子质量约为23.3 |
| D、其他条件不变时,缩小体积,H2O(g)的转化率随之降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,y的转化率为75% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| C、增大压强使平衡向生成Z的方向移动,平衡常数不变 |
| D、改变温度但不可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,能增大活化分子百分数,所以反应速率增大 |
| B、使用正催化剂,能增大活化分子百分数,所以反应速率增大 |
| C、对于任何反应,增大压强都可加快反应速率 |
| D、升高温度,只能增大吸热反应的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用500mL容量瓶配制450mL 0.1 moL/L的氢氧化钠溶液,用托盘天平称取氢氧化钠固体1.8g |
| B、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 |
| C、用量筒量取浓硫酸时,仰视读数 |
| D、其它环节正确,只是在定容时俯视容量瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+3 | B、+4 | C、+5 | D、+6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com