
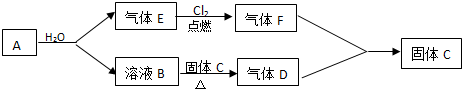
分析 A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;
氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,结合物质的性质分析解答.
解答 解:A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;
氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,
(1)根据上面的分析可知,A的名称为钠,F的化学式为HCl,
故答案为:钠;HCl;
(2)在加热条件下,氯化铵和氢氧化钠反应生成氯化钠、氨气和水,反应方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O,
故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O;
(3)F+D→C反应为氨气遇氯化氢生成氯化铵的反应,反应的化学方程式为NH3+HCl=NH4Cl,
故答案为:NH3+HCl=NH4Cl;
(4)HCl极易溶于水生成盐酸,所以氯化氢在空气中遇水蒸气生成盐酸小液滴而产生白雾,
故答案为:盐酸小液滴.
点评 本题考查了无机物的推断,根据氨气和浓盐酸反应特征、钠焰色反应特征来分析解答即可,明确实验室制取氨气的方法,及氨气的检验方法,难度不大,注意烟和雾的区别.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CaCO3 | C. | H2O | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②⑤ | D. | ⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量15%的Na2CO3溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe2+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
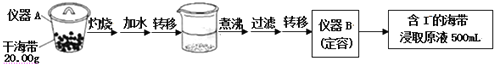
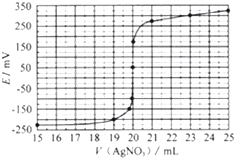
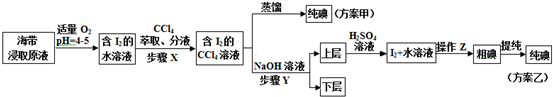
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com