
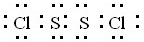 ,
,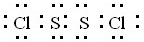 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、c(Fe3+)=0.l mol?L-1的溶液中K+、NH4+、SCN-、SO42- |
| B、水电离出的c(OH-)=1.0×10-13mo1?L-1的溶液:Na+、K+、MnO4-、Cr2O72- |
| C、能与铝反应生成氢气的溶液中:K+、C1-、Na+、SiO32- |
| D、0.1mol?L-1 NaOH溶液K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
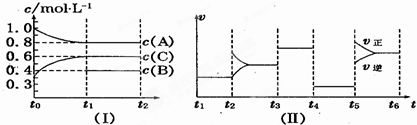
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:
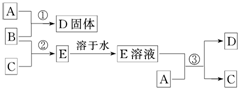 室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:
室温下,单质A、B、C分别为银白色固体、黄绿色气体、无色气体,且A在空气中燃烧会变成淡黄色粉末.在合适的反应条件下,它们可以按下面框图进行反应,且E溶液是无色的.请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1g H2和1g N2 |
| B、1mol H2O和1g H2O |
| C、3.2g O2和2.24L的空气(标准状况下) |
| D、44gCO2和6.02×1022个O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com