
下列关于元素周期表和元素周期律的说法中正确的是
A. 目前已发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B. 元素的性质随着原子序数的增加而呈周期性变化
C. 元素周期表中共有18列,对应18个族
D. 元素周期表中右上方区域的非金属元素多用于制造半导体材料
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2017届吉林省长白山市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是
A. 三种元素的最高正化合价中,Z的最大
B. W溶液显碱性或中性
C. 原子半径:X>Y>Z
D. Y的最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
实验室保存下列试剂,其保存方法和理由描述都正确的是( )
A. 固体NaOH,存放在带有橡皮塞的广口瓶中,防止与空气接触被氧化
B. 碳酸钠晶体,存放在干燥密封的广口瓶中,防止风化而碎裂成粉末
C. 液溴,存放在带橡皮塞的细口瓶中,防止挥发
D. 过氧化钠粉末,存放在带玻璃塞的细口瓶中,防止吸收水分而变质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
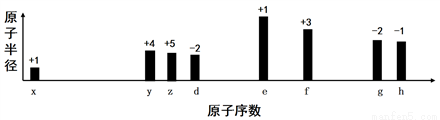
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列化学用语的书写正确的是
A. O2-的离子结构示意图: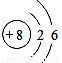
B. 质子数为27、中子数为60的Co原子: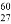 Co
Co
C. H2O的电子式:
D. 用电子式表示氢溴酸的形成过程为: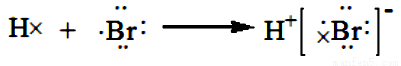
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:实验题
某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做如下探究实验。
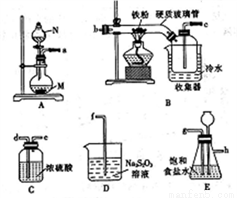
已知:①无水氯化铁在空气中易潮解,加热易升华;
②工业上,向500~600 ℃的铁屑中通人氯气可生产无水氯化铁;
③向炽热的铁屑中通入氯化氢可以生产无水氯化亚铁和氢气,
(1)仪器N的名称是____________, N中盛有浓盐酸,烧瓶M中的固体试剂___________(填化学式)。
(2)装置的连接顺序为_______→ → → → → → →d→e→f。(用小写字母表示,部分装置可以重复使用)
(3)若缺少装置E,则对本实验造成的影响是___________________________。
(4)已知硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂,反应后Na2S2O3被氧化为Na2SO4,则装置D中
发生反应的离子方称式为_________________________。
(5)实验结束并冷却后,将硬质玻璃管及收集器中的物质 一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
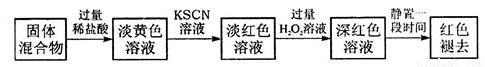
①淡红色溶液中加入过量H2O2溶液后,溶液红色加深的原因是__________________(用离子方程式表示)。
②已知红色褪去的同时有气体生成,经检验气体为O2。该小组对红色褪去的原因进行探究。
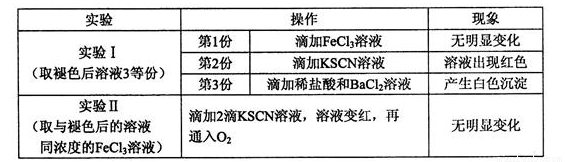
由实验Ⅰ和Ⅱ可得出的结论为____________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:选择题
化学与生活、社会发展息息相关,下列说法正确的是
A. 洗涤剂除油污的原理与热碱液除油污的原理相同
B. 食品包装内放置生石灰与放置硅胶的作用相同
C. 聚乙烯和聚氯乙烯的单体相同
D. 自来水中加入漂白粉与加入硫酸铝的作用相同
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:实验题
碱式碳酸铜[xCuCO3·yCu(OH)2],呈孔雀绿颜色.又称为孔雀石,是一种名贵的矿物宝石。它与铜与空气中的氧气、二氧化碳和水蒸气等物质反应产生的物质。CuSO4溶液与Na2CO3溶液反应可以得到碱式碳酸铜,我们将对其组成进行相关探究。
[沉淀制备]
称取12. 5 g胆矾(CuSO4• 5H2O)溶于87. 5mL蒸馏水中,滴加少量稀硫酸(体积可以忽略不计),充分搅拌后得到CuSO4溶液。向其中加入Na2CO3溶液,将所得蓝绿色悬浊液过滤,并用蒸馏水洗涤,再用无水乙醇洗涤,最后低溫烘干备用。
[实验探究]我们设计了如下装置,用制得的蓝绿色固体进行实验。
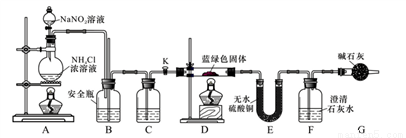
根据以上实验回答下列问题
(1)配制硫酸铜溶液的过程中滴加稀硫酸的作用是___________,所得硫酸铜溶液的溶质质量分数为_________
(2)实验室通常使用加热亚硝酸钠和氯化铵混合溶液的方法制取N2,该反应的化学方程为:__________。
⑶D装置加热前,需要首先打开活塞K,通入适量N2,然后关闭K,再点燃D处酒精灯。通入N2的作
用___________, B为安全瓶,其作用原理为_________,C中盛装的试剂应是__________。
(4)加热D后观察到的现象是________________。
(5)经查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用Ba(OH)2溶液代替澄清石灰水来定量测定蓝绿色固体的化学式,其原因是______________
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是______________。若装置F中使用Ba(OH)2溶液,实验结束后经称量,装置E的质量增加0.27 g,F中产生沉淀1.97 g。则该蓝绿色固体的化学式为_____________。[写成xCuCO3·yCu(OH)2的形式]
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:简答题
氮元素可以形成多种化合物。回答下列问题:
(1)基态氮原子的价电子排布式是____;C、N、O 三种元素电负性从小到大的顺序是________。
(2)肼(N2H4)分子中氮原子轨道的杂化类型是______;肼可用作火箭燃料,燃烧时发生的反应时N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=11038.7kJ·mol-1,若该反应中8molN-H键断裂,则形成的σ键有____mol;肼能与硫酸反应生成N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在______(填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)氨是________(填“极性”或“非极性”)分子;氨的沸点高于膦(PH3)的原因是________。
(4)将氨气通入硫酸铜水溶液中形成[Cu(NH3)4]SO4深蓝色溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______。
(5)单质铜和镍都是由金属键形成的晶体,元素铜和镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi的原因是_______。某镍白铜合金的立方晶胞结构如图所示。晶胞中镍原子与铜原子的个数比为_______。若合金的密度为dg/cm3,晶胞参数a=_________nm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com