
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||


 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
| A、+300 kJ?mol_1 |
| B、+150 kJ?mol_1 |
| C、-300 kJ?mol_1 |
| D、-150 kJ?mol_1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠保存在煤油中 |
| B、存放FeSO4溶液时加入少量铁粉 |
| C、NaOH溶液保存在带橡胶塞的玻璃试剂瓶中 |
| D、FeCl3溶液保存在广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe在一定条件下与水反应生成H2和Fe(OH)3 |
| B、Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液显红色 |
| C、Cl2与过量Fe粉反应生成FeCl2 |
| D、Fe遇冷浓H2SO4生成硫酸铁和氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
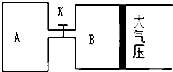 如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,
如图所示,当关闭K时,向容器A中充入1molX、1molY,向容器B中充入2molX、2molY,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com