
 .
.分析 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y元素最高正价与最低负价之和均为0,氢元素、ⅣA族元素符合,由原子序数可知,X为H元素,Y为C元素;Q与X同主族,Q原子序数大于氧,可知Q为Na.
(1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大;
(2)氢与碳能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质为乙炔;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,其中C是溶于水显酸性的气体,D是淡黄色固体,则C为CO2、D为Na2O2.如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为NaAlO2、B为Al(OH)3.
解答 解:X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.Z、R分别是地壳中含量最高的非金属元素和金属元素,则Z为O元素、R为Al;X、Y元素最高正价与最低负价之和均为0,氢元素、ⅣA族元素符合,由原子序数可知,X为H元素,Y为C元素;Q与X同主族,Q原子序数大于氧,可知Q为Na.
(1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Al>C>O>H,
故答案为:Na>Al>C>O>H;
(2)氢与碳能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质为C2H2,
故答案为:C2H2;
(3)上述五种元素中的若干种组成的化合物A、B、C、D,其中C是溶于水显酸性的气体,D是淡黄色固体,则C为CO2、D为Na2O2,则CO2的结构式为O=C=O,Na2O2的电子式为 ,
,
如果A、B均由三种元素组成,B为两性不溶物,结合转化关系可知,A为NaAlO2、B为Al(OH)3,偏铝酸根与二氧化碳、水反应生成氢氧化铝与碳酸根,A转化为B的反应离子方程式为:AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2 AlO2-+3 H2O+CO2=2 Al(OH)3+CO32-,
故答案为:O=C=O; ;NaAlO2;AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2 Al(OH)3+CO32-.
;NaAlO2;AlO2-+2H2O+CO2=Al(OH)3+HCO3-或2AlO2-+3H2O+CO2=2 Al(OH)3+CO32-.
点评 本题考查元素化合物推断、元素周期律、常用化学用语等,需要学生具备扎实的基础,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
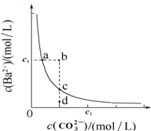
| A. | 通过蒸发可以使溶液由d点变到c点 | |
| B. | b点有BaCO3沉淀生成 | |
| C. | 升高温度,可以使d点变为c点 | |
| D. | 在a点加入Na2CO3,达平衡时c(Ba2+)≠c(CO32-),其Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
 ①的气态氢化物的电子式
①的气态氢化物的电子式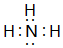 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
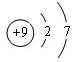 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32gO2所含有的原子数目为NA | |
| B. | 0.5mol CO2含有的原子数目为1.5 NA | |
| C. | 1mol H2O含有的水分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) 增大 | B. | Ka(HF)增大 | C. | $\frac{c({F}^{-})}{c({H}^{+})}$减小 | D. | $\frac{c({H}^{+})}{c(HF)}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
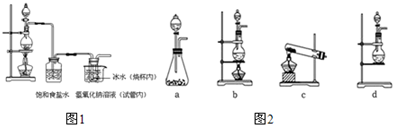
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com