

分析 I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小;非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水;
II:(3)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代入平衡常数表达式k=$\frac{c({H}_{2}S)}{c({H}_{2})}$计算;
A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大;
B.增大压强平衡不移动,但容器体积减小;
C.升高温度反应速率加快;
D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变;
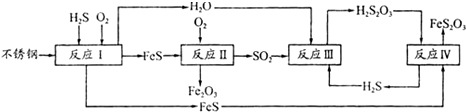
(4)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水;
(5)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,结合溶液中含有的离子书写;
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,反应由于生成硫化氢,不能说明FeS溶解性更强;
(6)由流程图可知,最终腐蚀产物为Fe2O3与FeS2O3;
硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸.
解答 解:I.(1)原子的电子层数越多,其原子半径越大,相同周期的元素中,原子半径随着原子序数的增大而减小,所以原子半径最大的元素是C元素,其最外层电子排布式为2S22P2;
非金属的非金属性越强,其氢化物越稳定、其最高价氧化物的水化物酸性越强、单质的氧化性越强等,
A.在NO2中氧元素显负价,氮元素显正价,说明氮气的氧化性小于氧气,则O元素的非极性大于N元素,故正确;
B.H2O的热稳定性比NH3的稳定,则O元素的非金属性大于N元素,故正确;
C.常温下H2O是液态而NH3是气态不能说明O元素的非金属性大于N元素,故错误;
D.O2比N2易液化不能说明O元素的非金属性大于N元素,故错误;
故答案为:2S22P2;AB;
(2)碱性条件下,铵根离子和氢氧根离子反应生成一水合氨,一水合氨不稳定易分解生成氨气和水,所以其离子方程式为:NH4++OH-=NH3.H2O=NH3↑+H2O,
故答案为:NH4++OH-=NH3.H2O=NH3↑+H2O,发生跑氨现象;
II:(3)反应前后气体的体积不变,用平衡时H2、H2S的物质的量代替浓度计算,故该反应的平衡常数k=$\frac{c({H}_{2}S)}{c({H}_{2})}$=$\frac{3mol}{3mol}$=1,
A.该反应正反应是吸热反应,温度升高平衡向正反应移动,平衡常数增大,图象与实际相符合,故A正确;
B.增大压强平衡不移动,但容器体积减小,硫化氢的浓度增大,故B正确;
C.升高温度反应速率加快,图象中正反应速率不变,故C错误;
D.增大硫化氢的浓度,等效为增大压强,平衡不移动,各组分的含量不变,图象与实际不相符,故D错误;
故答案为:1;AB;
(4)由流程图可知,反应I中铁与硫化氢、氧气反应生成FeS与水,反应方程式为:2Fe+2H2S+O2=2FeS+2H2O,
故答案为:2Fe+2H2S+O2=2FeS+2H2O;
(5)由电离平衡常数可知,H2S2O3属于弱酸,Na2S2O3为强碱弱酸盐,溶液呈碱性;
阳离子带的电离等于阴离子带的电离,故c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);
反应Ⅳ是H2S2O3与FeS反应生成FeS2O3与H2S,方程式为:H2S2O3+FeS=FeS2O3+H2S↑,符合复分解反应,反应能进行由于生成硫化氢气体,不能说明FeS溶解性更强,
故答案为:碱;c(Na+)+c(H+)=2c(S2O32-)+c(HS2O3-)+c(OH-);复分解反应;不能;
(6)由流程图可知,最终腐蚀产物为Fe2O3、FeS2O3;
硫化氢与硫酸铜反应生成硫化铜沉淀与硫酸,反应离子方程式为:Cu2++H2S=CuS↓+2H+,
故答案为:Fe2O3、FeS2O3;Cu2++H2S=CuS↓+2H+.
点评 本题考查化学工艺流程、化学平衡常数、化学平衡影响因素等常用化学用语、盐类水解等,题目综合性较大,难度中等,是对学生综合能力的考查,是一道不错的能量考查题目.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.
过渡金属元素及其化合物在合金材料以及催化剂等方面应用非常广泛.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:实验题
某化学课外小组查阅资料得知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。如图是制取溴苯的装置。试回答:
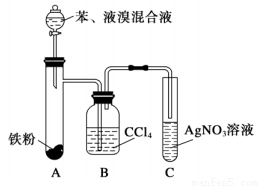
(1)装置A中发生反应的化学方程式是______________________。
(2)装置C中看到的现象是______________,证明________________。
(3)装置B是吸收瓶,内盛CCl4液体。如果没有B装置而将A、C直接相连,你认为是否妥当?__________(填“是”或“否”),理由是_____________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯_________(填“上”或“下”)层为溴苯,这说明溴苯___________且_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为单质铝,则Y的气体产物只能是氢气 | |
| B. | 若X为NaHCO3,则Z一定有CO2 | |
| C. | 若Y、Z为含铝元素的两种盐,则X一定为Al(OH)3 | |
| D. | 若X为乙酸乙酯,则生成物Y、Z中均含有乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、OH-、Cl-、SO42- | B. | H+、NH4+、Ca2+、NO3- | ||
| C. | Na+、AlO2-、Cl-、SO42- | D. | Na+、C6H5O-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
已知FeCl3溶液中存在下列平街:Fe3+ + 3 H2O Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )
Fe(OH)3 + 3 H+,下列操作能使FeCl3的水解程度增大且溶液的酸性增强的是( )
A.加入FeCl3固体 B.加水 C.加入少量浓盐酸 D.升温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com