
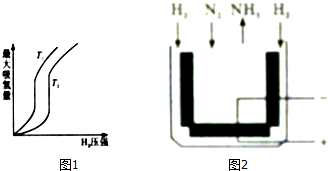
分析 (1)在压强相同的条件下,T1对应的吸氢量大,又T1<T2,也就是T2→T1,降温平衡正向移动,据此分析;
(2)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1 ①
由H2的燃烧热为286kJ•mol-1,则2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1 ②
根据盖斯定律,由②×3-①×2解答;
(3)①化学平衡常数是平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
②设参加反应的氮气的物质的量,再根据三段法求出各自的物质的量,再根据体积分数求出未知数,然后根据v=$\frac{△c}{△t}$计算反应速率;
③化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答;
④依据影响化学反应速率的因素分析,增大压强,浓度、升高温度速率都增大,平衡是气体体积减小的放热反应,依据平衡移动原理分析判断;
⑤阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气;根据电极方程式计算阴极产生的气体在标准状态下的体积.
解答 解:(1)在压强相同的条件下,T1对应的吸氢量大,又T1<T2,也就是T2→T1,降温平衡正向移动,所以正反应是放热反应,则△H<0;
故答案为:<;
(2)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1 ①
由H2的燃烧热为286kJ•mol-1,则2H2(g)+O2(g)=2H2O(l)△H=-572kJ•mol-1 ②
根据盖斯定律,由②×3-①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-572kJ•mol-1×3+92kJ•mol-1×2=-1532 kJ•mol-1
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1532 kJ•mol-1;
(3)①该反应的平衡常数表达式K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$,故答案为:K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})•c{\;}^{3}(H{\;}_{2})}$;
②设参加反应的氮气的物质的量xmol,
N2 +3H2 $?_{高温高压}^{催化剂}$ 2NH3
开始(mol):1 3 0
变化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
5min后达到平衡,平衡时氨的体积分数为$\frac{2x}{1-x+3-3x+2x}$×100%=25%,解:x=0.4,
H2的反应速率v(H2)=$\frac{\frac{0.4mol}{10L}}{5min}$×3=0.024mol/(L﹒min),故答案为:0.024mol/(L﹒min);
③a.该可逆反应反应前后气体的物质的量发生变化,则容器内压强也不停变化,所以容器中压强不变,能说明反应到达平衡,故a正确;
b.因为反应前后总质量不变,又体积不变,所以混合气体的密度始终不变,则混合气体的密度不变,不能说明反应到达平衡,故b错误;
c.3v(H2)=2v(NH3),未指明正逆方向,不能说明反应到达平衡,故c错误;
d.c(N2):c(H2):c(NH3)=1:3:2时可能处于平衡状态,可能不处于平衡状态,与反应的条件有关,故d错误;
故选:a;
④a.选用更高效的催化剂,能增大正反应速率,但平衡不移动,故a错误;
b.升高温度,能增大正反应速率,但平衡向吸热的逆向移动,故b错误;
c.及时分离出氨气,反应速率减慢,故c错误;
d.增加H2的浓度,增大反应物的浓度,能增大正反应速率,平衡正向移动,故d正确;
故选d;
⑤阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,当阳极失去0.6mol电子时,则阴极得到0.6mol电子,所以产生的气体在标准状态下的体积为$\frac{0.6mol}{6}$×2×22.4L/mol=4.48L,故答案为:N2+6e-+6H+=2NH3;4.48L.
点评 本题考查了图象的理解应用,主要是化学反应速率、化学平衡影响因素、平衡标志以及电解池原理等知识,掌握基础是解题关键,题目难度中等,注意知识的迁移应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s),△H=-216kJ•mol-1,反应物总能量小于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1mol氢分子的能量为E2,则2E1>E2 | |
| C. | 101kPa时,2H2(g)+O2(g)=2H2O(1),△H=-571.6kJ•mol-1,若生成气态水,△H小于-571.6kJ•mol-1 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
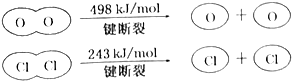
| A. | 反应A的△H>-115.6kJ•mol-1 | |
| B. | H2O中H-O键比HCl中H-Cl键弱 | |
| C. | 由II中的数据判断氯元素的非金属性比氧元素强 | |
| D. | 断开1molH-O键与断开1molH-Cl键所需能量相差31.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | |
| D | E | F |
 ,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
,实验室制取气体甲的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 15 | 20 | 25 | 30 | 35 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3溶液 | B. | NaCl溶液 | C. | AgNO3溶液 | D. | CuCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com