
| A. | 决定反应速率的因素是反应物的浓度 | |
| B. | 在金厲钠与足量水反应中,增加水的量能加快反应速率 | |
| C. | 在可逆反应中,反应物不可能完全转化为生成物 | |
| D. | 可逆反应达到平衡时,正、逆反应速率相等且等于零 |
分析 A.决定反应速率的主要因素是反应物自身的性质;
B.根据增加纯液体的量,浓度不变,速率也不变;
C.在可逆反应中,反应物不能完全转化为生成物;
D.可逆反应达到平衡时,正、逆反应速率相等
解答 解:A.决定反应速率的主要因素是反应物自身的性质,反应物的浓度是影响因素,故A错误;
B.增加纯液体的量,浓度不变,速率也不变,所以在金属钠与足量水反应中,增加水的量反应速率不变,故B错误;
C.在可逆反应中,反应物不能完全转化为生成物,所以反应物的转化率不能达到百分之百,故C正确;
D.可逆反应达到平衡时,正、逆反应速率相等且不等于零,故D错误;
故选:C.
点评 本题主要考查了化学反应速率和限度,难度不大,根据所学知识即可完成,需要注意的是增加纯液体的量,浓度不变,速率也不变.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | C5H12 | B. | C4H10 | C. | C3H6 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可得到丙三醇 | |
| B. | 可用碘检验淀粉是否发生水解 | |
| C. | 蛋白质水解的最终产物均为氨基酸 | |
| D. | 纤维素水解与淀粉水解得到的最终产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L | |
| B. | 0.1mol•L-1的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8 gNa2S和7.8 gNa2O2中含有的阴离子数目均为0.1 NA | |
| D. | l.8 g818O2分子与1.8 g818O3分子中含有的中子数不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高的温度都难以分解 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 组成人体蛋白质的氨基酸有必须和非必须之分 | |
| C. | 乙醇和乙酸都是厨房中常用的调味品 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
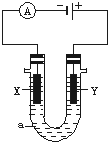 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色 | |
| C. | 将0.001 mol•L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀 | |
| D. | 向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com