
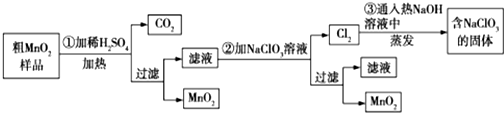
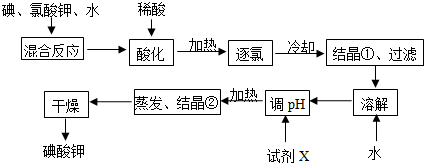
分析 粗MnO2(含有较多的MnO、MnCO3)样品中加入过量的稀硫酸,由于MnO2不溶于硫酸,则样品中的MnO和MnCO3分别和硫酸反应生成可溶性的MnSO4,过滤得滤液为硫酸锰溶液,加入NaClO3发生反应为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,再过滤得到滤液和二氧化锰固体,而氯气与热的氢氧化钠反应生成氯酸钠方程式为:3Cl2+6NaOH=NaClO3+NaCl+3H2O,
(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,据此答题;
(2)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,根据方程式转移电子数计算生成的氧化产物的物质的量;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据Na2S2O3的物质的量可计算出二氧化锰的质量,进而确定该样品中MnO2含量.
解答 解:(1)二氧化锰有氧化性,在加热时浓盐酸能被MnO2氧化生成Cl2,所以不能用盐酸代替硫酸,
故答案为:否;浓盐酸能被MnO2氧化生成Cl2;
(2)操作②中硫酸锰溶液,加入NaClO3发生氧化还原反应生成MnO2、Cl2,反应的离子方程式为5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+,ClO3-作氧化剂,MnO2作氧化产物,则氧化性:ClO3->MnO2;当NaClO3转移2mol电子时,消耗NaClO3为0.4mol,则生成MnO2为1mol;NaClO3在常温下与盐酸反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:>;5Mn2++2ClO3-+4H2O=5MnO2+Cl2↑+8H+;1;
(3)①二氧化锰在碱性条件下被氧气氧化可制取K2MnO4,反应的方程式为2MnO2+4KOH+O2=2 K2MnO4+2H2O,为使二氧化锰能被充分氧化,工业上不断搅拌,使反应物与O2充分接触,
故答案为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;使反应物与O2充分接触;
②电解K2MnO4的浓溶液时,生成高锰酸钾和氢气,电解的总反应方程式为2 K2MnO4+2H2O═KMnO4+2KOH+H2↑,
故答案为:2 K2MnO4+2H2O═KMnO4+2KOH+H2↑;
(4)根据反应MnO2+4HCl+2KI═MnCl2+I2+2KCl+2H2O,I2+2Na2S2O3═2NaI+Na2S4O6可得关系式MnO2~2Na2S2O3,根据题意可知Na2S2O3的物质的量为0.1000mol/L×0.001VL=0.0001Vmol,所以二氧化锰的质量为0.0001Vmol×87g/mol×$\frac{1}{2}$=0.00435Vg,则该样品中MnO2含量为$\frac{0.00435Vg}{ag}$×100%=$\frac{0.435V}{a}$%,
故答案为:$\frac{0.435V}{a}$.
点评 本题考查物质的制备,为高考常见题型和高频考点,题目难度中等,把握流程中发生的化学反应及原电池和电解池原理为解答的关键,注意掌握化学实验基本操作方法和根据关系式进行化学计算,试题侧重分析能力及推断能力的考查.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
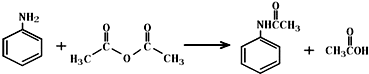
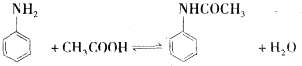 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
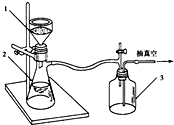
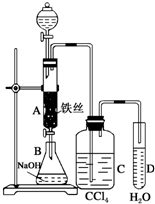 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2(g)和 3mol H2(g)具有的能量之和低于 2 mol NH3(g)具有的能量 | |
| B. | 将 1mol N2(g)和 3mol H2(g)置于一密闭容器中充分反应后放出 Q kJ 的热量 | |
| C. | 升高温度,平衡向逆反应方向移动,上述热化学方程式中的 Q 值减小 | |
| D. | 将一定量 N2、H2置于某密闭容器中充分反应放热 Q kJ,则此过程中有 3mol H2被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com